Ketonska tijela stvaraju jetra i koriste se kao izvor energije kada glukoza nije lako dostupna u ljudskom tijelu. Dva glavna ketonska tijela su acetoacetat (AcAc) i 3-beta-hidroksibutirat (3HB), dok je aceton treće i najmanje obilno, ketonsko tijelo. Ketoni su uvijek prisutni u krvi i njihove se razine povećavaju tijekom gladovanja i produžene vježbe. ketogeneza je biokemijski proces kojim organizmi proizvode ketonska tijela kroz raspad masnih kiselina i ketogenih aminokiselina.
Ketonska tijela su uglavnom generirana u mitohondrija jetrenih stanica, Ketogeneza se javlja kad su razine krvi u krvi niskog nivoa glukoze, osobito nakon što su iscrpljene druge stanične ugljikohidrate, poput glikogena. Taj se mehanizam može pojaviti iu slučaju nedostatka količine inzulina. Konačno se započinje proizvodnja ketonskih tijela kako bi se dobila dostupna energija koja se pohranjuje u ljudsko tijelo kao masne kiseline. Ketogeneza se događa u mitohondrijima gdje je samostalno regulirana.
Pregled sadržaja
Sažetak
Metabolizam ketonskog tijela središnji je čvor fiziološke homeostaze. U ovom pregledu razmatramo kako ketoni služe diskretnim metaboličkim ulogama koje optimiziraju performanse organa i organizma u različitim ostacima hranjivih tvari i štite od upale i ozljeda u više organskih sustava. Tradicionalno promatrane kao metaboličke supstrate uključene samo u ograničavanje ugljikohidrata, nedavna zapažanja naglašavaju važnost ketonskih tijela kao vitalnih metaboličkih i signalnih medijatora kada su ugljikohidrati u izobilju. Dopunjujući repertoar poznatih terapijskih opcija za bolesti živčanog sustava, nastale su buduće uloge za ketonska tijela u raku, kao i intrigantne zaštitne uloge u srcu i jetri, otvarajući terapeutske mogućnosti u bolesti povezane s pretilosti i kardiovaskularnim bolestima. Razgovaralo se o kontroverzi u metabolizmu i signalizaciji ketona kako bi pomirili klasičnu dogmu s suvremenim opažanjima.
Uvod
Ketonska tijela su vitalni alternativni izvor metaboličkog goriva za sve domene života, eukarije, bakterije i arheje (Aneja i sur., 2002.; Cahill GF Jr, 2006.; Krishnakumar i sur., 2008.). Metabolizam ketonskih tijela u ljudi je iskorišten za napajanje mozga tijekom epizodnih razdoblja nedostatka hranjivih tvari. Ketonska tijela su isprepletena s ključnim metaboličkim putevima sisavaca kao što su ?-oksidacija (FAO), ciklus trikarboksilne kiseline (TCA), glukoneogeneza, de novo lipogeneza (DNL) i biosinteza sterola. U sisavaca se ketonska tijela proizvode pretežno u jetri iz acetil-CoA dobivenog iz FAO-a i transportiraju se u ekstrahepatična tkiva radi terminalne oksidacije. Ova fiziologija pruža alternativno gorivo koje se pojačava relativno kratkim razdobljima posta, što povećava dostupnost masnih kiselina i smanjuje dostupnost ugljikohidrata (Cahill GF Jr, 2006; McGarry i Foster, 1980; Robinson i Williamson, 1980). Oksidacija ketonskih tijela postaje značajan doprinos ukupnom energetskom metabolizmu sisavaca unutar ekstrahepatičnog tkiva u bezbroj fizioloških stanja, uključujući gladovanje, gladovanje, neonatalno razdoblje, nakon vježbanja, trudnoću i pridržavanje dijete s niskim udjelom ugljikohidrata. Ukupne koncentracije ketonskih tijela u cirkulaciji kod zdravih odraslih ljudi obično pokazuju cirkadijalne oscilacije između približno 100-250 µM, porastu na ~1 mM nakon dugotrajne tjelovježbe ili 24 sata gladovanja i mogu se akumulirati do čak 20 mM u patološkim stanjima kao što je dijabetička ketoacidoza (C. GF Jr, 2006; Johnson i sur., 1969b; Koeslag i sur., 1980; Robinson i Williamson, 1980; Wildenhoff i sur., 1974). Ljudska jetra proizvodi do 300 g ketonskih tijela dnevno (Balasse i Fery, 1989.), koja doprinose između 5-20% ukupne potrošnje energije u nahranjenim, nataštenim i izgladnjelim stanjima (Balasse i sur., 1978; Cox et al. al., 2016.).
Nedavne studije sada naglašavaju imperativne uloge za ketonska tijela u metabolizmu stanica sisavaca, homeostazi i signalizaciji u širokom rasponu fizioloških i patoloških stanja. Osim što služe kao energetska goriva za ekstrahepatska tkiva poput mozga, srca ili skeletnog mišića, ketonska tijela igraju ključne uloge kao signalizacijske posrednike, vozače proteina posttranslational modifikacije (PTM) i modulatore upale i oksidacijskog stresa. U ovom pregledu pružamo klasične i moderne poglede na plejotropske uloge ketonskih tijela i njihov metabolizam.
Pregled ketonskog metabolizma tijela
Brzinom jetrene ketogeneze određuje se orkestrirani niz fizioloških i biokemijskih transformacija masti. Primarni regulatori uključuju lipolizu masnih kiselina iz triacilglicerola, transport u i kroz plazemsku membranu hepatocita, transport u mitohondrije preko karnitin palmitoiltransferaze 1 (CPT1), spiralu o-oksidacije, aktivnost TCA ciklusa i srednje koncentracije, redoks potencijal i hormonski regulatori od ovih procesa, pretežno glukagon i inzulin [pregledano u (Arias i sur., 1995 .; Ayte i sur., 1993 .; Ehara i sur., 2015 .; Ferre i sur., 1983 .; Kahn i sur., 2005.; McGarry i Foster , 1980; Williamson i sur., 1969)]. Klasično se ketogeneza promatra kao put prelijevanja, u kojem acetil-CoA dobiven iz oksidacije premašuje aktivnost citrat sintaze i / ili dostupnost oksaloacetata za kondenzaciju da bi se stvorio citrat. Intermedijari s tri ugljika pokazuju anti-ketogeno djelovanje, vjerojatno zbog njihove sposobnosti da prošire bazen oksaloacetata za konzumaciju acetil-CoA, ali koncentracija acetil-CoA u jetri sama po sebi ne određuje ketogenu brzinu (Foster, 1967; Rawat i Menahan, 1975; Williamson i sur., 1969). Regulacija ketogeneze hormonskim, transkripcijskim i post-translacijskim događajima zajedno podupire ideju da molekularni mehanizmi koji fino podešavaju ketogenu brzinu ostaju u potpunosti nerazumljivi (vidi Regulaciju HMGCS2 i SCOT / OXCT1).
Ketogeneza se javlja prvenstveno u jetri mitohondrijskog matriksa brzinom proporcionalnom ukupnoj oksidaciji masti. Nakon transporta acilnih lanaca kroz mitohondrijske membrane i a-oksidacije, mitohondrijska izoforma 3-hidroksimetilglutaril-CoA sintaze (HMGCS2) katalizira sudbinu kondenzacije acetoacetil-CoA (AcAc-CoA) i acetil-CoA za stvaranje HMG-CoA (Slika 1A). HMG-CoA liaza (HMGCL) cijepa HMG-CoA kako bi se oslobodio acetil-CoA i acetoacetat (AcAc), a potonji se mitohondrijskom d-? OHB dehidrogenazom (d-? OHB) mitohondrijskom d-? OHB dehidrogenazom (d-? OHB) reducira na d -? BDH1) u reakciji bliske ravnoteže NAD + / NADH (Bock i Fleischer, 1975; LEHNINGER i sur., 1960). Konstanta ravnoteže BDH1 pogoduje proizvodnji d-? OHB, ali omjer tijela ketona AcAc / d-? OHB izravno je proporcionalan omjeru NAD + / NADH mitohondrija, a time i aktivnost BDH1 oksidoreduktaze modulira redoks potencijal mitohondrija (Krebs i sur., 1969; Williamson i sur., 1967). AcAc se također može spontano dekarboksilirati u aceton (Pedersen, 1929), izvor slatkog mirisa kod ljudi koji pate od ketoacidoze (tj. Ukupna serumska ketonska tijela> ~ 7 mM; AcAc pKa 3.6,? OHB pKa 4.7). Mehanizmi putem kojih se ketonska tijela transportiraju kroz unutarnju membranu mitohondrija nisu poznati, ali AcAc / d-? OHB se oslobađaju iz stanica putem monokarboksilatnih transportera (kod sisavaca, MCT 1 i 2, također poznati kao otopljeni nosači 16A članovi porodice 1 i 7) i transportirani u cirkulaciji u ekstrahepatična tkiva radi terminalne oksidacije (Cotter i sur., 2011.; Halestrap i Wilson, 2012.; Halestrap, 2012.; Hugo i sur., 2012.). Koncentracije ketonskih tijela u cirkulaciji veće su od koncentracija u ekstrahepatičnim tkivima (Harrison i Long, 1940.) što ukazuje da se ketonska tijela prenose niz gradijent koncentracije. Mutacije gubitka funkcije u MCT1 povezane su sa spontanim napadima ketoacidoze, što ukazuje na kritičnu ulogu u uvozu ketonskog tijela.
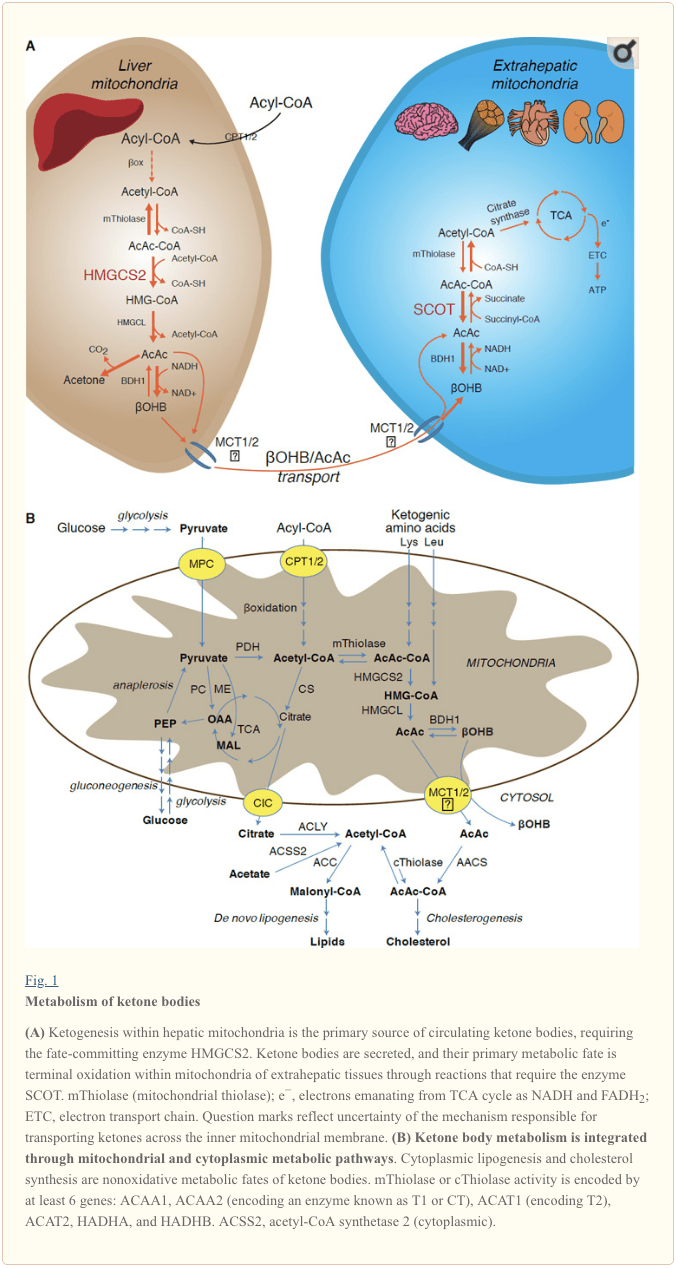
Izuzev potencijalnog preusmjeravanja ketonskih tijela u neoksidativne sudbine (vidi Neoksidativne metaboličke sudbine ketonskih tijela), hepatociti nemaju sposobnost metabolizma ketonskih tijela koja proizvode. Ketonska tijela koja se novo sintetiziraju jetrom (i) kataboliziraju se u mitohondrijima ekstrahepatičnih tkiva do acetil-CoA, koji je dostupan u TCA ciklusu za terminalnu oksidaciju (slika 1A), (ii) preusmjeravaju se na puteve sinteze lipogeneze ili sterola ( Slika 1B), ili (iii) izlučuje se urinom. Kao alternativno energetsko gorivo, ketonska tijela strašno oksidiraju u srcu, skeletnim mišićima i mozgu (Balasse i Fery, 1989; Bentourkia i sur., 2009; Owen i sur., 1967; Reichard i sur., 1974; Sultan, 1988. ). Ekstrahepatični mitohondrijski BDH1 katalizira prvu reakciju oksidacije? OHB, pretvarajući je u povratni AcAc (LEHNINGER i sur., 1960 .; Sandermann i sur., 1986.). Citoplazmatska d-? OHB-dehidrogenaza (BDH2) sa samo 20% identičnosti sekvence u odnosu na BDH1 ima visoku Km za ketonska tijela, a također igra ulogu u homeostazi željeza (Davuluri i sur., 2016.; Guo i sur., 2006.) . U ekstrahepatičnoj mitohondrijskoj matrici, AcAc se aktivira na AcAc-CoA izmjenom CoA dijela iz sukcinil-CoA u reakciji kataliziranom jedinstvenom CoA transferazom sisavaca, sukcinil-CoA: 3-okso-kiselina-CoA transferaza (SCOT, CoA transferaza; kodiran OXCT1), kroz reakciju gotovo ravnoteže. Slobodna energija koja se oslobađa hidrolizom AcAc-CoA veća je od energije sukcinil-CoA, što pogoduje nastanku AcAc. Tako dolazi do oksidacijskog tijeka ketonskog tijela zbog masovnog djelovanja: obilna opskrba AcAc i brza potrošnja acetil-CoA kroz citrat sintazu pogoduju stvaranju AcAc-CoA (+ sukcinat) SCOT-om. Značajno je da, za razliku od glukoze (heksokinaze) i masnih kiselina (acil-CoA sintetaze), aktiviranje ketonskih tijela (SCOT) u oksidirajući oblik ne zahtjeva ulaganje ATP-a. Reverzibilna reakcija AcAc-CoA tiolaze [katalizirana bilo kojom od četiri mitohondrijske tiolaze kodirane ili ACAA2 (koja kodira enzim poznat kao T1 ili CT), ACAT1 (kodira T2), HADHA ili HADHB] daje dvije molekule acetil-CoA, koji ulaze u TCA ciklus (Hersh i Jencks, 1967; Stern i sur., 1956; Williamson i sur., 1971). Tijekom ketotičnih stanja (tj. Ukupnih serumskih ketona> 500 µM), ketonska tijela postaju značajni doprinos trošenju energije i brzo se koriste u tkivima sve dok ne dođe do usvajanja ili zasićenja oksidacije (Balasse i sur., 1978; Balasse i Fery, 1989; Edmond i sur., 1987). Vrlo mali udio ketonskih tijela dobivenih iz jetre može se lako izmjeriti u urinu, a stope iskorištavanja i reapsorpcije putem bubrega proporcionalne su koncentraciji u cirkulaciji (Goldstein, 1987; Robinson i Williamson, 1980). Tijekom izrazito ketotičnih stanja (> 1 mM u plazmi), ketonurija služi kao polukvantitativni izvjestitelj o ketozi, iako većina kliničkih ispitivanja ketonskih tijela u urinu otkriva AcAc, ali ne i? OHB (Klocker i sur., 2013.).
Ketogenih supstrata i njihovog utjecaja na metabolizam hepatocita
Ketogeni supstrati uključuju masne kiseline i aminokiseline (Slika 1B). Katabolizam aminokiselina, naročito leucin, generira oko 4% ketonskih tijela u post-apsorpcijskom stanju (Thomas i sur., 1982). Tako acetil-CoA supstratni bazen za generiranje ketonskih tijela uglavnom potječe od masnih kiselina, jer tijekom stanja smanjene opskrbe ugljikohidratima, piruvat ulazi u ciklus jetrenog TCA primarno preko anaplcoze, tj. ATP-ovisnu karboksilaciju do oksaloacetata (OAA), ili za malate (MAL), a ne oksidativnom dekarboksilacijom na acetil-CoA (Jeoung i sur., 2012; Magnusson i sur., 1991; Merritt i sur., 2011). U jetri, glukoza i piruvat doprinose zanemarivo na ketogenezu, čak i kada je piruvat dekarboksilacija do acetil-CoA maksimalna (Jeoung et al., 2012).
Acetyl-CoA podrazumijeva nekoliko uloga integralnih za metabolizam posrednika u jetri nakon proizvodnje ATP-a putem terminalne oksidacije (vidi također Integracija metabolizma ketonskog tijela, posttranslacijska modifikacija i fiziologija stanica). Acetyl-CoA alosterički aktivira (i) piruvat karboksilazu (PC), čime aktivira metabolički kontrolni mehanizam koji povećava anaplerotični ulazak metabolita u ciklus TCA (Owen i sur., 2002; Scrutton i Utter, 1967) i (ii) piruvat dehidrogenaze kinaze koja fosforilira i inhibira piruvat dehidrogenazu (PDH) (Cooper i sur., 1975), čime se dodatno povećava protok piruvata u TCA ciklus anaplerozom. Nadalje, citoplazmatski acetil-CoA, čiji je bazen povećan mehanizmima koji pretvaraju mitohondrijski acetil-CoA na transportabilne metabolite, inhibira oksidaciju masnih kiselina: acetil-CoA karboksilaza (ACC) katalizira konverziju acetil-CoA na malonil-CoA, lipogeni supstrat i alosterični inhibitor mitohondrijskog CPT1 [pregledan u (Kahn i sur., 2005, McGarry i Foster, 1980)]. Stoga, mitohondrijski acetil-CoA baze i regulira i regulira put kroz spajanje ketogeneze, koji orkestrira ključne aspekte metabolizma posrednika u jetri.
Nonoksidativne metaboličke sudbine ketonskih tijela
Dominantna sudbina jetrenih ketona je SCOT-ovisna extrahepatska oksidacija. Međutim, AcAc se može izvesti iz mitohondrija i koristiti u anaboličkim putevima pretvaranjem u AcAc-CoA pomoću ATP-ovisne reakcije katalizirane citoplazmatskim acetoacetil-CoA sintetazom (AACS, slika 1B). Ovaj put je aktivan tijekom razvoja mozga i u laktacijskoj mliječnoj žlijezdi (Morris, 2005, Robinson i Williamson, 1978, Ohgami et al., 2003). AACS je također izrazito izražen u masnom tkivu i aktivirani osteoklasti (Aguilo et al., 2010; Yamasaki i sur., 2016). Cytoplasmic AcAc-CoA može biti orijentiran citosolnom HMGCS1 prema biosintezi sterola, ili cijepiti bilo kojom od dvije citoplazmatske tiolaze do acetil-CoA (ACAA1 i ACAT2), karboksilirati na malonil-CoA i pridonijeti sintezi masnih kiselina (Bergstrom et 1984, Edmond, 1974, Endemann i sur., 1982, Geelen i sur., 1983, Webber i Edmond, 1977).
Iako fiziološki značaj tek treba utvrditi, ketoni mogu poslužiti kao anabolički supstrat čak i u jetri. U umjetnim eksperimentalnim kontekstima, AcAc može pridonijeti čak polovici novosintetiziranih lipida i do 75% novo sintetiziranog kolesterola (Endemann i sur., 1982 .; Geelen i sur., 1983 .; Freed i sur., 1988.). Budući da je AcAc izveden iz nepotpune oksidacije jetrene masti, sposobnost AcAc da doprinosi lipogenezi in vivo podrazumijeva uzaludno hepatično ciklusiranje, gdje se ketoni dobiveni iz masti mogu koristiti za proizvodnju lipida, pojam čiji fiziološki značaj zahtijeva eksperimentalnu validaciju, ali može poslužiti adaptivne ili neprilagođene uloge (Solinas i sur., 2015). AcAc oštro opskrbljuje holesterogenezu, s niskim AACS Km-AcAc (~ 50 µM), što pogoduje aktivaciji AcAc čak i u napojnom stanju (Bergstrom i sur., 1984.). Dinamička uloga metabolizma citoplazmatskog ketona predložena je u primarnim mišjim embrionalnim neuronima i u adipocitima izvedenim iz 3T3-L1, jer je AACS nokdaun oslabio diferencijaciju svakog tipa stanica (Hasegawa i sur., 2012a; Hasegawa i sur., 2012b). Nokautiranje AACS-a kod miševa in vivo smanjilo je kolesterol u serumu (Hasegawa i sur., 2012c). SREBP-2, glavni transkripcijski regulator biosinteze kolesterola i receptor aktiviran proliferatorom peroksizoma (PPAR) -? su aktivatori AACS transkripcije i reguliraju njegovu transkripciju tijekom razvoja neurita i u jetri (Aguilo i sur., 2010 .; Hasegawa i sur., 2012.c). Zajedno, metabolizam citoplazmatskog ketonskog tijela može biti važan u odabranim uvjetima ili u povijesti bolesti, ali je nedovoljan za zbrinjavanje ketonskih tijela dobivenih iz jetre, jer se masivna hiperketonemija javlja u okruženju selektivnog oštećenja primarne oksidativne sudbine gubitkom mutacija funkcije do SCOT (Berry i sur., 2001.; Cotter i sur., 2011.).
Regulacija HMGCS2 i SCOT / OXCT1
Divergencija mitohondrija iz gena koji kodira citosolni HMGCS pojavila se rano u evoluciji kralježnjaka zbog potrebe za podrškom ketogeneze jetre kod vrsta s višim omjerima mozga i tjelesne težine (Boukaftane et al., 1994, Cunnane i Crawford, 2003). HMGCS2 mutacije koje su prirodno nastale s gubitkom funkcije kod ljudi uzrokuju djelovanje hipoketotske hipoglikemije (Pitt i sur., 2015, Thompson et al., 1997). Robusna ekspresija HMGCS2 ograničena je na hepatocite i epitelij koštane srži, a njegova ekspresija i enzimatska aktivnost koordiniraju se različitim mehanizmima (Mascaro i sur., 1995, McGarry i Foster, 1980, Robinson i Williamson, 1980). Dok cijeli opseg fizioloških stanja koji utječu na HMGCS2 zahtijeva daljnje razjašnjenje, njegovo izražavanje i / ili aktivnost regulirano je tijekom ranog postnatalnog razdoblja, starenja, dijabetesa, gladovanja ili gutanja ketogenetske prehrane (Balasse i Fery, 1989, Cahill GF Jr, 2006 Girard i sur., 1992, Hegardt, 1999, Satapati i sur., 2012, Sengupta i sur., 2010). U fetusu, metilacija 5-a granične regije Hmgcs2 gena obrnuto se korelira s njegovom transkripcijom i djelomično je preokrenuta nakon rođenja (Arias i sur., 1995, Ayte i sur., 1993, Ehara i sur., 2015, Ferre i sur. ., 1983). Slično tome, hepatski Bdh1 pokazuje razvojni ekspresijski uzorak koji se povećava od rođenja do odbića, a također je induciran ketogenom prehranom u fibroblastnom faktoru rasta (FGF) -21-ovisan način (Badman i sur., 2007; Zhang et al., 1989 ). Ketogeneza kod sisavaca vrlo je osjetljiva na inzulin i glukagon, potiskuju se i stimuliraju (McGarry i Foster, 1977). Inzulin potiskuje lipolizu masnog tkiva, time lišavajući kogenezu supstrata, dok glukagon povećava ketogenski tok kroz direktan učinak na jetru (Hegardt, 1999). Hmgcs2 transkripcija je stimulirana pomoću faktora transkripcije forkera FOXA2, koji je inhibiran inzulin-fosfatidilinozitol-3-kinazom / Akt, a inducira se signalizacijom glukagon-cAMP-p300 (Arias i sur., 1995; Hegardt, 1999; Quant et al. , 1990, Thumelin i sur., 1993, von Meyenn i sur., 2013, Wolfrum i sur., 2004, Wolfrum i sur., 2003). PPAR? (Rodriguez i sur., 1994.), zajedno sa svojim ciljem, FGF21 (Badman i sur., 2007.) također induciraju transkripciju Hmgcs2 u jetri tijekom gladovanja ili davanja ketogene prehrane (Badman i sur., 2007.; Inagaki i sur., 2007.) ). Indukcija PPAR-a? može se dogoditi prije prijelaza iz fetalne u neonatalnu fiziologiju, dok se aktivaciji FGF21 može pogodovati u ranom neonatalnom razdoblju putem? OHB-posredovane inhibicije histon-deacetilaze (HDAC) -3 (Rando i sur., 2016.). mTORC1 (cilj sisavaca kompleksa rapamicina) ovisna inhibicija PPAR? transkripcijska aktivnost također je ključni regulator ekspresije gena Hmgcs2 (Sengupta i sur., 2010.), a jetra PER2, glavni cirkadijski oscilator, neizravno regulira ekspresiju Hmgcs2 (Chavan i sur., 2016.). Nedavna zapažanja ukazuju da interheukin-6 inducirani ekstrahepatičnim tumorom narušava ketogenezu putem PPAR-a? suzbijanje (Flint i sur., 2016.).
HMGCS2 enzimska aktivnost je regulirana kroz više PTMs. HMGCS2 serinska fosforilacija poboljšala je njegovu aktivnost in vitro (Grimsrud i sur., 2012). Aktivnost HMGCS2 alosterički se inhibira succinil-CoA i sukciniliranjem lizinskog ostatka (Arias et al., 1995, Hegardt, 1999, Lowe i Tubbs, 1985, Quant i sur., 1990, Rardin et al, 2013, Reed i sur. 1975, Thumelin i sur., 1993). Succiniliranje HMGCS2, HMGCL i BDH1 lizinskih ostataka u hepatičnim mitohondrijima su ciljevi NAD + ovisne deacilaze sirtuin 5 (SIRT5) (Rardin et al., 2013). Aktivnost HMGCS2 također je poboljšana pomoću SIRT3 lizin deacetilizacije, a moguće je da preslušavanje između acetilacije i sukcinilacije regulira aktivnost HMGCS2 (Rardin et al., 2013; Shimazu et al., 2013). Unatoč sposobnosti ovih PTM-a da reguliraju HMGCS2 Km i Vmax, fluktuacije tih PTM-a još nisu pažljivo mapirane i nisu potvrđene kao mehanističke pokretače ketogeneze in vivo.
SCOT se izražava u svim stanicama sisavaca koje sadrže mitohondrije, osim onih hepatocita. Važnost SCOT aktivnosti i ketolize pokazala su se kod SCOT-KO miševa koji pokazuju uniformnu letalnost zbog hiperketemijske hipoglikemije unutar 48h nakon rođenja (Cotter i sur., 2011). Gubitak SCOT-a specifičan za tkivo u neuronima ili skeletnim miocitima izaziva metaboličke abnormalnosti tijekom gladovanja, ali nije smrtonosna (Cotter i sur., 2013b). Kod ljudi, nedostatak SCOT-a pokazuje rano u životu s teškom ketoacidozom, uzrokujući letargiju, povraćanje i komu (Berry i sur., 2001; Fukao i sur., 2000; Kassovska-Bratinova i sur., 1996; Niezen-Koning i sur. , 1997, Saudubray et al., 1987, Snyderman i sur., 1998, Tildon i Cornblath, 1972). Relativno malo se zna na staničnoj razini o SCOT genu i regulatorima ekspresije proteina. Ekspresija Oxct1 mRNA i SCOT proteina i aktivnost se smanjuju u ketotičkim stanjima, eventualno putem mehanizama koji ovise o PPAR-u (Fenselau i Wallis, 1974, Fenselau i Wallis, 1976, Grinblat et al, 1986, Okuda i sur., 1991, Turko et al 2001, Wentz i sur., 2010). Kod dijabetičke ketoacidoze, neusklađenost između ketogeneze jetre i izvanhepatske oksidacije postaje pogoršana oštećenjem SCOT aktivnosti. Prekomjerna ekspresija inzulin-neovisnog transportera glukoze (GLUT1 / SLC2A1) u kardiomiocitima također inhibira ekspresiju gena Oxct1 i downregulates oksidaciju terminalnih ketona u ne-ketotičkom stanju (Yan i sur., 2009). U jetri, obilje Oxct1 mRNA je suprimirano microRNA-122 i histonom metiliranjem H3K27me3 koji se očituju pri prijelazu iz fetusa u neonatalno razdoblje (Thorrez et al., 2011). Međutim, suzbijanje jetrene Oxct1 ekspresije u postnatalnom razdoblju prvenstveno se može pripisati evakuaciji hematopoetskih progenitorima koji izražavaju Oxct1 iz jetre, a ne gubitkom prethodno postojećeg ekspresije Oxct1 u terminalno diferenciranim hepatocitima. Zapravo, ekspresija Oxct1 mRNA i SCOT proteina u diferenciranim hepatocitima su izrazito niska (Orii i sur., 2008).
SCOT je također reguliran PTMs. Enzim je hiperacetiliran u mozgu SIRT3 KO miševa, koji također pokazuju smanjenu AcAc ovisnu acetil-CoA produkciju (Dittenhafer-Reed i sur., 2015). Neenzimatska nitracija tirozinskih ostataka SCOT također smanjuje njegovu aktivnost, što je opisano u srcima različitih modela dijabetičkih miševa (Marcondes i sur., 2001; Turko i sur., 2001; Wang et al., 2010a). Nasuprot tome, nitracija triptofanskih ostataka povećava SCOT aktivnost (Brégère i sur., 2010, Rebrin et al., 2007). Mogu se pojaviti molekularni mehanizmi nitriranja ili de-nitriranja specifičnih za ostatke, koji služe za modulaciju SCOT aktivnosti i zahtijevaju razjašnjenje.
Kontroverze u ekstrahepatičkoj ketogenezi
U sisavaca je primarni ketogeni organ jetra, a samo hepatociti i epitelne stanice crijeva obilno izražavaju mitohondrijsku izoformu HMGCS2 (Cotter i sur., 2013a; Cotter i sur., 2014; McGarry i Foster, 1980; Robinson i 1980 Williamson) . Anaerobna bakterijska fermentacija složenih polisaharida daje butirat, koji apsorbiraju kolonociti kod sisavaca za terminalnu oksidaciju ili ketogenezu (Cherbuy i sur., 1995.), što može igrati ulogu u diferencijaciji kolonocita (Wang i sur., 2016.). Isključujući crijevne epitelne stanice i hepatocite, HMGCS2 je gotovo odsutan u gotovo svim ostalim stanicama sisavaca, ali izgledi za ekstrahepatičnu ketogenezu su povećani u tumorskim stanicama, astrocitima središnjeg živčanog sustava, bubrega, gušterače ? stanicama, pigmentnom epitelu retine (RPE), pa čak i u skeletnim mišićima (Adijanto i sur., 2014.; Avogaro i sur., 1992.; El Azzouny i sur., 2016.; Grabacka i sur., 2016.; Kang i sur., 2015. ; Le Foll i sur., 2014.; Nonaka i sur., 2016.; Takagi i sur., 2016.a; Thevenet i sur., 2016.; Zhang i sur., 2011.). Ektopični HMGCS2 uočen je u tkivima kojima nedostaje neto ketogeni kapacitet (Cook i sur., 2016.; Wentz i sur., 2010.), a HMGCS2 pokazuje prospektivne ketogenezi neovisne 'moonlighting' aktivnosti, uključujući unutar stanične jezgre (Chen et al. , 2016.; Kostiuk i sur., 2010.; Meertens i sur., 1998.).
Bilo koje ekstrahepatično tkivo koje oksidira ketonska tijela također ima potencijal akumulirati ketonska tijela putem mehanizama neovisnih o HMGCS2 (slika 2A). Međutim, ne postoji ekstrahepatično tkivo u kojem stabilna koncentracija ketonskog tijela premašuje onu u cirkulaciji (Cotter i sur., 2011; Cotter i sur., 2013b; Harrison i Long, 1940.), što naglašava da se ketonska tijela prevoze niz gradijent koncentracije putem mehanizama ovisnih o MCT1 / 2. Jedan mehanizam prividne ekstrahepatične ketogeneze može zapravo odražavati relativno oštećenje oksidacije ketona. Dodatna potencijalna objašnjenja spadaju u područje stvaranja ketonskog tijela. Prvo, de novo ketogeneza može se dogoditi reverzibilnom enzimskom aktivnošću tiolaze i SCOT (Weidemann i Krebs, 1969). Kada je koncentracija acetil-CoA relativno visoka, reakcije normalno odgovorne za oksidaciju AcAc djeluju u obrnutom smjeru (GOLDMAN, 1954). Drugi se mehanizam događa kada se intermedijari izvedeni iz a-oksidacije akumuliraju uskim grlom TCA ciklusa, a AcAc-CoA se pretvara u l-? OHB-CoA reakcijom kataliziranom mitohondrijskom 3-hidroksiacil-CoA dehidrogenazom, a dalje 3-hidroksibutirillom CoA-deacilaze do 1980-OHB, koji se ne može razlikovati masenom spektrometrijom ili rezonantnom spektroskopijom od fiziološkog enantiomera d-OHB (Reed i Ozand, 2011). l-? OHB se može kromatografski ili enzimatski razlikovati od d-? OHB i prisutan je u ekstrahepatičnim tkivima, ali ne i u jetri ili krvi (Hsu i sur., 1984). Ketogeneza jetre proizvodi samo d-? OHB, jedini enantiomer koji je supstrat BDH (Ito i sur., 1987.; Lincoln i sur., 1980.; Reed i Ozand, 1982 .; Scofield i sur., 1982.; Scofield i sur., 2.). Treći mehanizam neovisan o HMGCS1990 stvara d-? OHB katabolizmom aminokiselina, posebno onim leucina i lizina. Četvrti mehanizam samo je očit jer je posljedica artefakta za obilježavanje i stoga se naziva pseudoketogenezom. Ovaj se fenomen može pripisati reverzibilnosti SCOT i reakcija tiolaze, a može prouzročiti precjenjivanje prometa ketonskog tijela zbog izotopskog razrjeđenja ketonskog traga za tijelo u ekstrahepatičnom tkivu (Des Rosiers i sur., 1988 .; Fink i sur., 1990.) . Unatoč tome, pseudoketogeneza u većini konteksta može biti zanemariva (Bailey i sur., 1978 .; Keller i sur., 2). Shema (slika XNUMXA) ukazuje na koristan pristup koji treba primijeniti uzimajući u obzir povišenu koncentraciju ketona u ravnotežnom stanju tkiva.
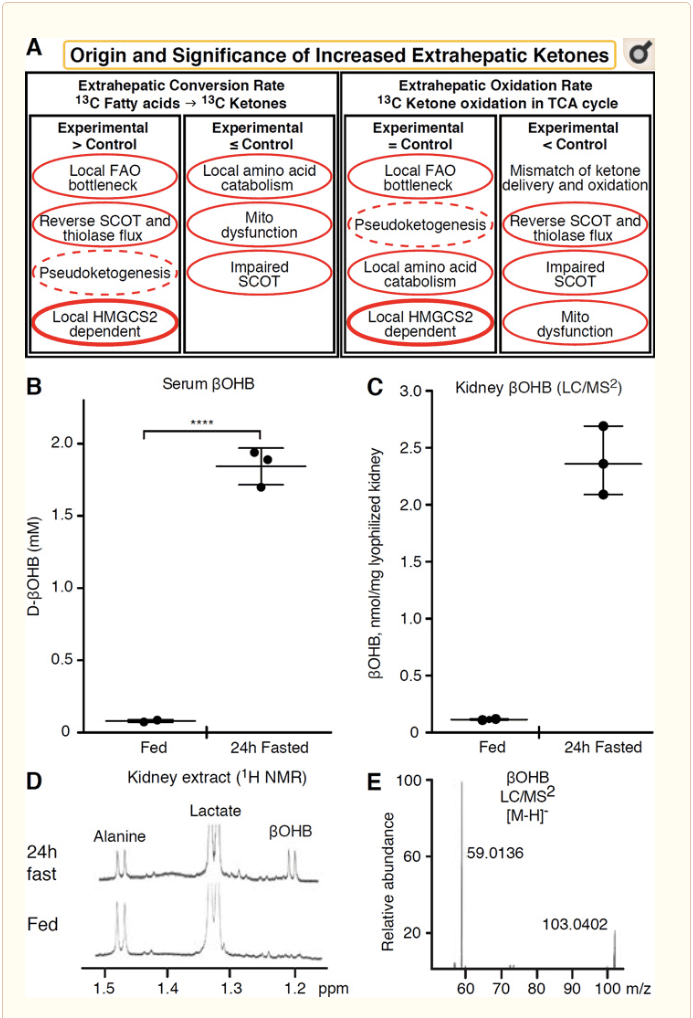

Bubrezi su nedavno dobili pozornost kao potencijalno ketogeni organ. U velikoj većini država, bubreg je neto potrošač ketonskih tijela dobivenih iz jetre, izlučujući ili reapsorbirajući ketonska tijela iz krvotoka, a bubreg općenito nije generator ili koncentrator neto ketonskih tijela (Robinson i Williamson, 1980.). Autori klasične studije zaključili su da minimalna bubrežna ketogeneza kvantificirana u umjetnom eksperimentalnom sustavu nije fiziološki relevantna (Weidemann i Krebs, 1969.). Nedavno je došlo do zaključka o bubrežnoj ketogenezi kod mišjih modela s dijabetesom i nedostatkom autofagije, no vjerojatnije je da višeorganski pomaci u metaboličkoj homeostazi mijenjaju integrativni metabolizam ketona putem unosa na više organa (Takagi i sur., 2016a; Takagi i sur., 2016b; Zhang i sur., 2011.). Jedna nedavna publikacija sugerira bubrežnu ketogenezu kao zaštitni mehanizam protiv ishemijsko-reperfuzijske ozljede u bubregu (Tran i sur., 2016.). Apsolutne stabilne koncentracije ?OHB iz ekstrakata bubrežnog tkiva miševa zabilježene su na ~4-12 mM. Kako bismo provjerili je li to održivo, kvantificirali smo koncentracije ?OHB u bubrežnim ekstraktima hranjenih i 24-satnih miševa. Koncentracije ?OHB u serumu porasle su s ~100 µM na 2 mM s 24-satnim gladovanjem (slika 2B), dok su koncentracije ?OHB u stanju dinamičke ravnoteže u bubrežnom stanju približno 100 µM u stanju hranjenja, a samo 1 mM u stanju gladovanja 24 sata (slika 2C- E), opažanja koja su u skladu s koncentracijama kvantificiranim prije više od 45 godina (Hems i Brosnan, 1970.). Ostaje moguće da bi u ketotičnim stanjima ketonska tijela dobivena iz jetre mogla biti renoprotektivna, ali dokazi za bubrežnu ketogenezu zahtijevaju daljnju potkrepu. Uvjerljivi dokazi koji podržavaju pravu ekstrahepatičku ketogenezu predstavljeni su u RPE (Adijanto i sur., 2014.). Predloženo je da ova intrigantna metabolička transformacija potencijalno omogući protok ketona dobivenih iz RPE do fotoreceptorskih ili Müller glia stanica, što bi moglo pomoći u regeneraciji vanjskog segmenta fotoreceptora.
? OHB kao posrednik u signaliziranju
Iako su energetski bogata, ketonska tijela imaju provokativnu 'nekanonsku' signalnu ulogu u staničnoj homeostazi (slika 3) (Newman i Verdin, 2014; Rojas-Morales i sur., 2016). Na primjer, ?OHB inhibira HDAC klase I, što povećava acetilaciju histona i na taj način inducira ekspresiju gena koji smanjuju oksidativni stres (Shimazu i sur., 2013.). ?OHB je sam po sebi kovalentni modifikator histona na rezidue lizina u jetri dijabetičkih miševa natašte ili streptozotocinom induciranih (Xie et al., 2016.) (također vidjeti dolje, Integracija metabolizma ketonskih tijela, posttranslacijska modifikacija i fiziologija stanice, i Ketonska tijela, oksidativni stres i neuroprotekcija).
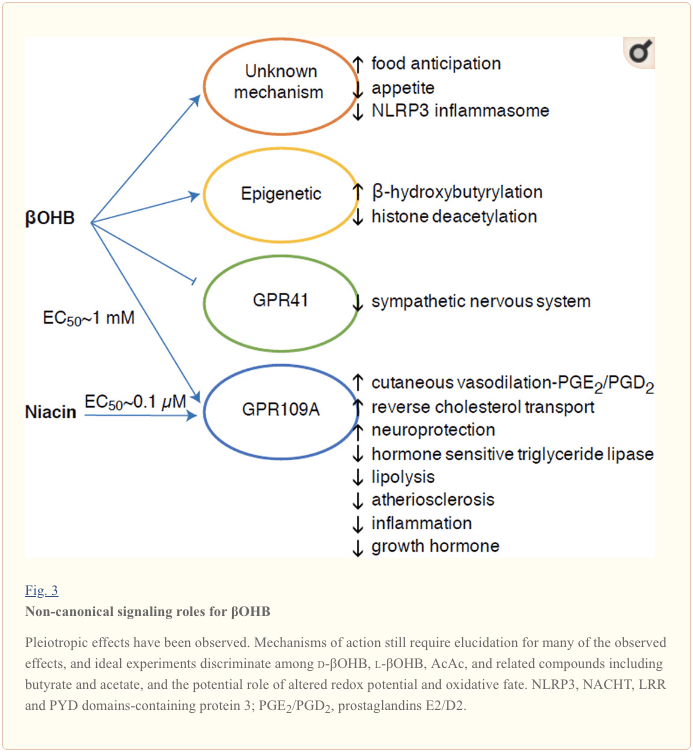
? OHB je također efektor putem receptora povezanih s G-proteinima. Kroz nejasne molekularne mehanizme, potiskuje aktivnost simpatičkog živčanog sustava i smanjuje ukupnu potrošnju energije i otkucaje srca inhibirajući signal kratkog lanca masnih kiselina putem receptora povezanog s G proteinima (GPR41) (Kimura i sur., 41.). Jedan od najviše proučavanih signalnih učinaka? OHB-a odvija se kroz GPR2011A (poznat i kao HCAR109), član podskupine GPCR-a karboksilne kiseline izražen u masnom tkivu (bijelo i smeđe) (Tunaru i sur., 2.), te u imunološke stanice (Ahmed i sur., 2003.). ? OHB je jedini poznati endogeni ligand GPR2009A receptora (EC109 ~ 50 uM) koji se aktivira d-? OHB, 770-OHB i butiratom, ali ne i AcAc (Taggart i sur., 2005.). Visoki prag koncentracije za aktivaciju GPR109A postiže se poštivanjem ketogene prehrane, gladovanjem ili tijekom ketoacidoze, što dovodi do inhibicije lipolize masnog tkiva. Antilipolitički učinak GPR109A nastavlja se inhibicijom adenilil ciklaze i smanjenim cAMP, inhibirajući hormonski osjetljivu triglicerid lipazu (Ahmed i sur., 2009 .; Tunaru i sur., 2003.). To stvara petlju negativne povratne sprege u kojoj ketoza postavlja modulacijsku kočnicu na ketogenezu smanjenjem oslobađanja neesterificiranih masnih kiselina iz adipocita (Ahmed i sur., 2009 .; Taggart i sur., 2005.), što je učinak koji se može uravnotežiti simpatički nagon koji potiče lipolizu. Niacin (vitamin B3, nikotinska kiselina) moćan je (EC50 ~ 0.1 µM) ligand za GRP109A, koji se učinkovito koristi desetljećima za dislipidemije (Benyo i sur., 2005.; Benyo i sur., 2006.; Fabbrini i sur., 2010.a; Lukasova i sur., 2011 .; Tunaru i sur., 2003). Iako niacin pojačava reverzni transport kolesterola u makrofazima i smanjuje aterosklerotske lezije (Lukasova i sur., 2011), učinci? OHB na aterosklerotske lezije ostaju nepoznati. Iako receptor GPR109A ima zaštitne uloge i postoje intrigantne veze između upotrebe ketogene prehrane kod moždanog udara i neurodegenerativnih bolesti (Fu i sur., 2015.; Rahman i sur., 2014.), zaštitna uloga? OHB putem GPR109A nije dokazana in vivo .
Konačno,? OHB može utjecati na apetit i sitost. Metaanaliza studija koja su mjerila učinke ketogenih i vrlo niskoenergetskih dijeta zaključila je da sudionici koji jedu ove dijete pokazuju veću sitost u usporedbi s kontrolnom dijetom (Gibson i sur., 2015.). Međutim, vjerodostojno objašnjenje ovog učinka su dodatni metabolički ili hormonalni elementi koji mogu modulirati apetit. Na primjer, miševi koji su se održavali na ketogenoj prehrani glodavaca pokazivali su povećanu potrošnju energije u usporedbi s miševima hranjenim chow-om, unatoč sličnom unosu kalorija, a cirkulirajući leptin ili geni peptida koji reguliraju hranjenje nisu se promijenili (Kennedy i sur., 2007.). Među predloženim mehanizmima koji sugeriraju suzbijanje apetita pomoću? OHB uključuju i signalizaciju i oksidaciju (Laeger i sur., 2010). Studije delecije gena za cirkadijanski ritam (Per2) i imunoprecipitacije kromatina specifične za hepatocite otkrile su da PER2 izravno aktivira gen Cpt1a, a neizravno regulira Hmgcs2, što dovodi do oštećenja ketoze kod miševa nokauta Per2 (Chavan i sur., 2016.). Ti su miševi pokazivali oslabljeno iščekivanje hrane, što je djelomično obnovljeno sustavnom primjenom? OHB. Buduće studije bit će potrebne kako bi se potvrdilo da je središnji živčani sustav izravna meta? OHB i je li potrebna oksidacija ketona za uočene učinke ili je uključen drugi signalni mehanizam. Drugi su se istražitelji pozivali na mogućnost lokalne ketogeneze izvedene iz astrocita unutar ventromedijalnog hipotalamusa kao regulatora unosa hrane, ali ova preliminarna zapažanja također će imati koristi od genetskih procjena i procjena temeljenih na protoku (Le Foll i sur., 2014.). Odnos između ketoze i nedostatka hranjivih sastojaka ostaje zanimljiv jer su glad i sitost važni elementi u neuspjelim pokušajima mršavljenja.
Integracija ketone metabolizma tijela, post-translacijske modifikacije i stanične fiziologije
Ketonska tijela doprinose skupljenim bazenima acetil-CoA, ključnom međuproduktu koji ima istaknute uloge u staničnom metabolizmu (Pietrocola et al., 2015). Jedna uloga acetil-CoA je služiti kao supstrat acetilacije, enzimski katalizirane kovalentne modifikacije histona (Choudhary et al., 2014; Dutta et al., 2016; Fan et al., 2015; Menzies et al., 2016 ). Veliki broj dinamički acetiliranih mitohondrijskih proteina, od kojih se mnogi mogu pojaviti putem neenzimatičkih mehanizama, također su nastali iz računalnih proteomskih studija (Dittenhafer-Reed i sur., 2015, Hebert i sur., 2013, Rardin et al., 2013 Shimazu i sur., 2010). Lizin deacetilaze koriste cinkov kofaktor (npr. Nukleokitozolni HDAC) ili NAD + kao su-supstrat (sirtuini, SIRT) (Choudhary et al., 2014; Menzies et al., 2016). Acetilproteom služi kao i senzor i efektor ukupnog staničnog acetil-CoA bazena, jer fiziološke i genetske manipulacije svako rezultira neenzimskim globalnim varijacijama acetilacije (Weinert i sur., 2014). Kako unutarstanični metaboliti služe kao modulatori acetiliranja lizinskog ostatka, važno je razmotriti ulogu ketonskih tijela, čija je obilje vrlo dinamična.
? OHB je epigenetski modifikator kroz najmanje dva mehanizma. Povećane razine OHB izazvane postom, kalorijskim ograničenjem, izravnom primjenom ili produljenim vježbanjem izazivaju inhibiciju HDAC-a ili aktivaciju histon-acetiltransferaze (Marosi i sur., 2016.; Sleiman i sur., 2016.) ili do oksidacijskog stresa (Shimazu i sur., 2013.) . ? OHB inhibicija HDAC3 mogla bi regulirati metaboličku fiziologiju novorođenčeta (Rando i sur., 2016.). Neovisno,? OHB sam izravno modificira ostatke histon lizina (Xie i sur., 2016.). Dugotrajno gladovanje ili dijabetesna ketoacidoza inducirana steptozotocinom povećala je histon-hidroksibutirilaciju. Iako je broj mjesta lizin a-hidroksibutirilacije i acetilacije bio usporediv, primijećena je stehiometrijski veća histon a-hidroksibutirilacija od acetilacije. Na različite gene utjecali su histon-lizin-hidroksibutirilacija, nasuprot acetilaciji ili metilaciji, što sugerira različite stanične funkcije. Nije poznato je li? -Hidroksibutirilacija spontana ili enzimska, ali širi raspon mehanizama kroz ketonska tijela koja dinamički utječu na transkripciju.
Bitni događaji reprogramiranja stanica tijekom kalorijske restrikcije i nedostatka hranjivih sastojaka mogu biti posredovani u SIRT3 i SIRT5 ovisnoj deacetilaciji i desukcinilaciji mitohondrija, regulirajući ketogene i ketolitičke proteine na post-translacijskoj razini u jetri i ekstrahepatičkim tkivima (Dittenhafer-Reed et al., 2015; Hebert i sur., 2013; Rardin i sur., 2013; Shimazu i sur., 2010). Iako se stehiometrijska usporedba zauzetih mjesta ne mora izravno povezivati s promjenama u metaboličkom toku, acetilacija mitohondrija je dinamična i može biti potaknuta koncentracijom acetil-CoA ili pH mitohondrija, a ne enzimatskim acetiltransferazama (Wagner i Payne, 2013). Da SIRT3 i SIRT5 moduliraju aktivnosti enzima koji metaboliziraju ketonsko tijelo, postavlja se pitanje uzajamne uloge ketona u oblikovanju acetilproteoma, sukcinilproteoma i drugih dinamičnih staničnih ciljeva. Zapravo, kako varijacije ketogeneze odražavaju koncentracije NAD +, proizvodnja i brojnost ketona mogli bi regulirati aktivnost sirtuina, utječući tako na ukupne bazene acetil-CoA / sukcinil-CoA, acilproteom, a time i na mitohondrijsku i staničnu fiziologiju. ? -hidroksibutirilacija enzimskih ostataka lizina mogla bi dodati novi sloj staničnom reprogramiranju. U ekstrahepatičnim tkivima, oksidacija ketonskog tijela može potaknuti analogne promjene u homeostazi stanica. Iako je razdvajanje bazena acetil-CoA visoko regulirano i koordinira širok spektar staničnih promjena, sposobnost ketonskih tijela da izravno oblikuju i mitohondrijske i citoplazmatske koncentracije acetil-CoA zahtijeva pojašnjenje (Chen i sur., 2012 .; Corbet i sur., 2016; Pougovkina i sur., 2014 .; Schwer i sur., 2009 .; Wellen i Thompson, 2012). Budući da su koncentracije acetil-CoA čvrsto regulirane, a acetil-CoA nepropusna za membranu, presudno je razmotriti pokretačke mehanizme koji koordiniraju homeostazu acetil-CoA, uključujući brzine proizvodnje i terminalne oksidacije u TCA ciklusu, pretvorbu u ketonska tijela, mitohondrijske otjecanje putem karnitin acetiltransferaze (CrAT) ili izvoz acetil-CoA u citosol nakon pretvorbe u citrat i oslobađanje ATP citrat liazom (ACLY). Ključne uloge ovih potonjih mehanizama u staničnom acetilproteomu i homeostazi zahtijevaju odgovarajuće razumijevanje uloge ketogeneze i oksidacije ketona (Das i sur., 2015.; McDonnell i sur., 2016.; Moussaieff i sur., 2015.; Overmyer i sur., 2015; Seiler i sur., 2014; Seiler i sur., 2015; Wellen i sur., 2009; Wellen i Thompson, 2012). Za određivanje ciljeva i ishoda bit će potrebne konvergentne tehnologije u metabolomici i acilproteomici u postavci genetski manipuliranih modela.
Anti- i pro-upalne reakcije na ketonska tijela
Ketoza i ketonska tijela moduliraju upalu i rad imunoloških stanica, ali predloženi su različiti, pa čak i neskladni mehanizmi. Dugotrajno uskraćivanje hranjivih sastojaka smanjuje upalu (Youm i sur., 2015.), ali kronična ketoza dijabetesa tipa 1 je proupalno stanje (Jain i sur., 2002.; Kanikarla-Marie i Jain, 2015.; Kurepa i sur., 2012. ). Signalne uloge na osnovi OHB u upali nastaju na mehanizmu jer mnoge stanice imunološkog sustava, uključujući makrofage ili monocite, obilno izražavaju GPR109A. Iako? OHB ostvaruje pretežno protuupalni odgovor (Fu i sur., 2014.; Gambhir i sur., 2012.; Rahman i sur., 2014.; Youm i sur., 2015.), visoke koncentracije ketonskih tijela, posebno AcAc, mogu pokrenuti proupalni odgovor (Jain i sur., 2002 .; Kanikarla-Marie i Jain, 2015 .; Kurepa i sur., 2012).
Pregledane su protuupalne uloge liganda GPR109A u aterosklerozi, pretilosti, upalnim bolestima crijeva, neurološkim bolestima i raku (Graff i sur., 2016.). Ekspresija GPR109A pojačana je u RPE stanicama dijabetičkih modela, pacijentima s dijabetesom kod ljudi (Gambhir i sur., 2012.) i u mikrogliji tijekom neurodegeneracije (Fu i sur., 2014.). Protuupalni učinci? OHB pojačani su prekomjernom ekspresijom GPR109A u stanicama RPE, a ukidaju se farmakološkom inhibicijom ili genetskim nokautom GPR109A (Gambhir i sur., 2012.). ? OHB i egzogena nikotinska kiselina (Taggart i sur., 2005.), oboje daju protuupalni učinak na TNF? ili upala izazvana LPS-om smanjenjem razine proupalnih proteina (iNOS, COX-2) ili izlučenih citokina (TNFa, IL-1a, IL-6, CCL2 / MCP-1), djelomično inhibicijom NF -? B translokacija (Fu i sur., 2014.; Gambhir i sur., 2012.). ? OHB smanjuje ER stres i NLRP3 upale, aktivirajući antioksidativni stresni odgovor (Bae i sur., 2016.; Youm i sur., 2015.). Međutim, u neurodegenerativnoj upali, GPR109A-ovisna? OHB-posredovana zaštita ne uključuje upalne medijatore poput signalizacije MAPK puta (npr. ERK, JNK, p38) (Fu i sur., 2014), ali može zahtijevati PGD1 ovisan o COX-2 proizvodnja (Rahman i sur., 2014). Zanimljivo je da je makrofag GPR109A potreban za provođenje neuroprotektivnog učinka u modelu ishemijskog moždanog udara (Rahman i sur., 2014.), ali sposobnost? OHB-a da inhibira NLRP3 upale u makrofazima izvedenim iz koštane srži nije nezavisna od GPR109A (Youm i sur. ., 2015). Iako većina studija povezuje? OHB s protuupalnim učincima,? OHB može biti proupalni i povećati markere peroksidacije lipida u telećim hepatocitima (Shi i sur., 2014.). Protuupalni i proupalni učinci? OHB mogu tako ovisiti o tipu stanice, koncentraciji? OHB, trajanju izloženosti i prisutnosti ili odsutnosti ko-modulatora.
Za razliku od? OHB, AcAc može aktivirati proupalno signaliziranje. Povišeni AcAc, posebno s visokom koncentracijom glukoze, pojačava ozljedu endotelnih stanica kroz mehanizam ovisan o NADPH oksidazi / oksidativnom stresu (Kanikarla-Marie i Jain, 2015). Visoke koncentracije AcAc u pupkovini dijabetičarki bile su u korelaciji s većom stopom oksidacije proteina i koncentracijom MCP-1 (Kurepa i sur., 2012.). Visoki AcAc u dijabetičara bio je u korelaciji s TNF-om? ekspresija (Jain i sur., 2002.) i AcAc, ali ne i? OHB, inducirali su TNFa, ekspresiju MCP-1, akumulaciju ROS i smanjili razinu cAMP u stanicama humanog monocita U937 (Jain i sur., 2002 .; Kurepa i sur. ., 2012).
Pojava signalnih pojava ovisnih o ketonu u tijelu često se pokreće samo kod visokih koncentracija ketonskog tijela (> 5 mM), au slučaju mnogih studija koje povezuju ketone s pro- ili protuupalnim učincima, putem nejasnih mehanizama. Uz to, zbog kontradiktornih učinaka? OHB naspram AcAc na upalu i sposobnosti odnosa AcAc /? OHB da utječe na redoks potencijal mitohondrija, najbolji eksperimenti koji procjenjuju ulogu ketonskih tijela na staničnim fenotipovima uspoređuju učinke AcAc i? OHB u različitim omjerima i u različitim kumulativnim koncentracijama [npr. (Saito i sur., 2016.)]. Napokon, AcAc se komercijalno može kupiti samo kao litijeva sol ili kao etilni ester koji zahtijeva baznu hidrolizu prije upotrebe. Litij-kation neovisno inducira kaskade prijenosa signala (Manji i sur., 1995.), a AcAc anion je labilan. Konačno, studije koje koriste racemični d / l-? OHB mogu se zbuniti, jer se samo d-? OHB stereoizomer može oksidirati u AcAc, ali d-? OHB i l-? OHB mogu svaki signalizirati putem GPR109A, inhibirati NLRP3 upale, i služe kao lipogeni supstrati.
Tijela ketona, oksidativni stres i neuroprotekciju
Oksidativni stres obično se definira kao stanje u kojem su ROS-ovi višak zbog prevelike proizvodnje i / ili oslabljene eliminacije. Uloge ketonskih tijela u ublažavanju antioksidativnog i oksidativnog stresa široko su opisane i in vitro i in vivo, posebno u kontekstu neuroprotekcije. Budući da većina neurona iz masnih kiselina učinkovito ne generira visokoenergijske fosfate, ali oksidira ketonska tijela kad nema dovoljno ugljikohidrata, posebno su važni neuroprotektivni učinci ketonskih tijela (Cahill GF Jr, 2006; Edmond et al., 1987; Yang et al., 1987). U modelima oksidativnog stresa, indukcija BDH1 i suzbijanje SCOT sugeriraju da se metabolizam ketonskog tijela može reprogramirati kako bi se održale različite stanične signalizacije, redoks potencijal ili metabolički zahtjevi (Nagao i sur., 2016.; Tieu i sur., 2003.).
Ketonska tijela smanjuju stupanj staničnog oštećenja, ozljede, smrti i niže apoptoze u neuronima i kardiomiocitima (Haces i sur., 2008.; Maalouf i sur., 2007.; Nagao i sur., 2016.; Tieu i sur., 2003.). Pozvani mehanizmi su raznoliki i nisu uvijek linearno povezani s koncentracijom. Niske milimolarne koncentracije (d ili l)-?OHB hvataju ROS (hidroksilni anion), dok AcAc hvata brojne vrste ROS, ali samo u koncentracijama koje prelaze fiziološki raspon (IC50 20–67 mM) (Haces et al., 2008.) . Suprotno tome, povoljan utjecaj na redoks potencijal lanca prijenosa elektrona je mehanizam koji je obično povezan s d-?OHB. Dok su sva tri ketonska tijela (d/l-?OHB i AcAc) smanjila smrt neuronskih stanica i nakupljanje ROS-a potaknuto kemijskom inhibicijom glikolize, samo su d-?OHB i AcAc spriječili pad neuronskog ATP-a. Suprotno tome, u hipoglikemijskom modelu in vivo, (d ili l)-?OHB, ali ne i AcAc spriječili su peroksidaciju lipida hipokampusa (Haces i sur., 2008.; Maalouf i sur., 2007.; Marosi i sur., 2016.; Murphy, 2009. ; Tieu i sur., 2003.). In vivo studije na miševima hranjenim ketogenom dijetom (87% kcal masti i 13% proteina) pokazale su neuroanatomske varijacije antioksidativnog kapaciteta (Ziegler i sur., 2003.), gdje su najdublje promjene uočene u hipokampusu, s povećanjem glutation peroksidaze i ukupnog antioksidativnim kapacitetima.
Ketogena dijeta, ketonski esteri (također vidi Terapijska upotreba ketogene dijete i egzogena ketonska tijela) ili primjena ?OHB-a imaju neuroprotekciju u modelima ishemijskog moždanog udara (Rahman i sur., 2014.); Parkinsonova bolest (Tieu i sur., 2003.); napadaj toksičnosti kisika središnjeg živčanog sustava (D'Agostino i sur., 2013.); epileptički grčevi (Yum i sur., 2015.); sindrom mitohondrijalne encefalomiopatije, laktacidoze i epizoda sličnih moždanom udaru (MELAS) (Frey i sur., 2016.) i Alzheimerove bolesti (Cunnane i Crawford, 2003.; Yin i sur., 2016.). S druge strane, nedavno je izvješće pokazalo histopatološke dokaze neurodegenerativne progresije ketogenom dijetom u modelu transgenog miša abnormalnog popravka mitohondrijske DNA, unatoč povećanju mitohondrijske biogeneze i antioksidativnih potpisa (Lauritzen i sur., 2016.). Druga oprečna izvješća sugeriraju da izlaganje visokim koncentracijama ketonskih tijela izaziva oksidativni stres. Visoke doze ?OHB ili AcAc izazvale su lučenje dušikovog oksida, peroksidaciju lipida, smanjenu ekspresiju SOD, glutation peroksidaze i katalaze u hepatocitima teleta, dok je u hepatocitima štakora indukcija MAPK puta pripisana AcAc, ali ne i ?OHB (Abdelmegeed i sur. ; Shi i sur., 2004.; Shi i sur., 2014.).
Zajedno, većina izvještaja povezuje OHB s ublažavanjem oksidativnog stresa, jer njegova primjena inhibira proizvodnju ROS / superoksida, sprječava peroksidaciju lipida i oksidaciju proteina, povećava razinu antioksidativnih proteina i poboljšava mitohondrijsko disanje i proizvodnju ATP (Abdelmegeed et al., 2004; Haces i sur., 2008 .; Jain i sur., 1998 .; Jain i sur., 2002 .; Kanikarla-Marie i Jain, 2015.; Maalouf i sur., 2007.; Maalouf i Rho, 2008.; Marosi i sur., 2016.; Tieu i sur., 2003 .; Yin i sur., 2016 .; Ziegler i sur., 2003). Iako je AcAc izravno koreliran od? OHB s indukcijom oksidativnog stresa, ti se učinci nisu uvijek lako raščlaniti iz potencijalnih proupalnih odgovora (Jain i sur., 2002 .; Kanikarla-Marie i Jain, 2015 .; Kanikarla-Marie i Jain, 2016.). Štoviše, presudno je uzeti u obzir da očita antioksidativna korist koju daju pleiotropne ketogene dijete ne smiju sama prenijeti ketonska tijela, a neuroprotekciju koju daju ketonska tijela možda se ne može u potpunosti pripisati oksidacijskom stresu. Na primjer, tijekom nedostatka glukoze, u modelu nedostatka glukoze u kortikalnim neuronima,? OHB je stimulirao autofagični tok i spriječio nakupljanje autofagosoma, što je bilo povezano sa smanjenom neuronskom smrću (Camberos-Luna i sur., 2016.). d-? OHB inducira također kanonske antioksidativne proteine FOXO3a, SOD, MnSOD i katalazu, prospektivno inhibicijom HDAC (Nagao i sur., 2016.; Shimazu i sur., 2013.).
Non-alkoholna bolest jetrenog mlijeka (NAFLD) i metabolizam tijela ketona
NAFLD povezan s pretilošću i bezalkoholni steatohepatitis (NASH) najčešći su uzročnici bolesti jetre u zapadnim zemljama (Rinella i Sanyal, 2016.), a zatajenje jetre izazvano NASH-om jedan je od najčešćih razloga za transplantaciju jetre. Iako prekomjerno skladištenje triacilglicerola u hepatocitima> 5% težine jetre (NAFL) samo po sebi ne uzrokuje degenerativnu funkciju jetre, progresija na NAFLD u ljudi korelira sa sistemskom rezistencijom na inzulin i povećanim rizikom od dijabetesa tipa 2, a može pridonijeti i patogenezi bolesti kardiovaskularne bolesti i kronične bolesti bubrega (Fabbrini i sur., 2009.; Targher i sur., 2010.; Targher i Byrne, 2013.). Patogeni mehanizmi NAFLD-a i NASH-a nisu potpuno razumljivi, ali uključuju abnormalnosti metabolizma hepatocita, autofagiju hepatocita i stres endoplazmatskog retikuluma, funkciju imunoloških stanica hepatike, upalu masnog tkiva i sistemske medijatore upale (Fabbrini et al., 2009; Masuoka i Chalasani, 2013. ; Targher i sur., 2010; Yang i sur., 2010). Perturbacije metabolizma ugljikohidrata, lipida i aminokiselina javljaju se i doprinose pretilosti, dijabetesu i NAFLD-u kod ljudi i u modelnim organizmima [pregledano u (Farese i sur., 2012.; Lin i Accili, 2011.; Newgard, 2012.; Samuel i Shulman, 2012; Sun i Lazar, 2013)]. Iako se abnormalnosti hepatocita u metabolizmu citoplazmatskih lipida često opažaju u NAFLD-u (Fabbrini i sur., 2010b), uloga metabolizma mitohondrija koji upravlja oksidacijskim odlaganjem masti manje je jasna u patogenezi NAFLD-a. Abnormalnosti metabolizma mitohondrija javljaju se i doprinose patogenezi NAFLD / NASH (Hyotylainen i sur., 2016.; Serviddio i sur., 2011.; Serviddio i sur., 2008.; Wei i sur., 2008.). Postoji općenito (Felig i sur., 1974 .; Iozzo i sur., 2010.; Koliaki i sur., 2015.; Satapati i sur., 2015.; Satapati i sur., 2012.; Sunny i sur., 2011.), ali ne i jednolično ( Koliaki i Roden, 2013 .; Perry i sur., 2016 .; Rector i sur., 2010.) konsenzusa da se prije razvoja vjerodostojnog NASH-a oksidacija jetrenih mitohondrija, a posebno oksidacija masti, povećava kod pretilosti, sistemske rezistencije na inzulin i NAFLD. Vjerojatno je da se napretkom NAFLD pojavljuje heterogenost oksidacijskog kapaciteta, čak i među pojedinačnim mitohondrijima, i na kraju oksidacijska funkcija postaje oslabljena (Koliaki i sur., 2015 .; Rector i sur., 2010 .; Satapati i sur., 2008 .; Satapati i sur. ., 2012).
Ketogeneza se često koristi kao proxy za oksidaciju jetrene masti. Oštećenja ketogeneze pojavljuju se kako NAFLD napreduje na životinjskim modelima, a vjerojatno i na ljudima. Kroz nepotpuno definirane mehanizme, hiperinsulinemija suzbija ketogenezu, vjerojatno pridonoseći hipoketonemiji u usporedbi s vitkim kontrolama (Bergman i sur., 2007.; Bickerton i sur., 2008.; Satapati i sur., 2012.; Soeters i sur., 2009.; Sunny i sur. , 2011; Vice i sur., 2005). Ipak, sposobnost cirkulirajuće koncentracije ketona u tijelu da predvidi NAFLD kontroverzna je (Männistö i sur., 2015 .; Sanyal i sur., 2001.). Robusne kvantitativne metode magnetske rezonancije na životinjskim modelima otkrile su povećanu brzinu prometa ketona s umjerenom inzulinskom rezistencijom, ali smanjene stope bile su vidljive kod ozbiljnije rezistencije na inzulin (Satapati i sur., 2012.; Sunny i sur., 2010.). U pretilih ljudi s masnom jetrom stopa ketogenih tvari je normalna (Bickerton i sur., 2008.; Sunny i sur., 2011.), pa su stoga i stope ketogeneze smanjene u odnosu na povećano opterećenje masnim kiselinama u hepatocitima. Slijedom toga, acetil-CoA izveden iz a-oksidacije može se usmjeriti na terminalnu oksidaciju u TCA ciklusu, povećavajući terminalnu oksidaciju, glukoneogenezu koju pokreće fosfoenolpiruvat putem anapleroze / katapleroze i oksidativni stres. Acetil-CoA se također može podvrgnuti izvozu iz mitohondrija kao citrat, pretečni supstrat za lipogenezu (slika 4.) (Satapati i sur., 2015.; Satapati i sur., 2012.; Solinas i sur., 2015.). Iako ketogeneza postaje manje osjetljiva na inzulin ili post s produljenom pretilošću (Satapati i sur., 2012.), osnovni mehanizmi i posljedice toga još uvijek nisu potpuno shvaćeni. Noviji dokazi ukazuju da mTORC1 suzbija ketogenezu na način koji može biti nizvodno od inzulinske signalizacije (Kucejova i sur., 2016.), što je u skladu s zapažanjima da mTORC1 inhibira indukciju Hmgcs2 posredovanu PPAR? (Sengupta i sur., 2010.) ( također vidjeti Regulaciju HMGCS2 i SCOT / OXCT1).

Preliminarna opažanja naše skupine upućuju na nepovoljne hepatičke posljedice ketogene insuficijencije (Cotter i sur., 2014). Za testiranje hipoteze da oslabljena ketogeneza, čak iu stanjima ugljikohidratima, a time i "ne-ketogenim", doprinosi abnormalnom metabolizmu glukoze i izaziva steatohepatitis, generira mišji model označene ketogenetske insuficijencije primjenom antisense oligonukleotida (ASO) Hmgcs2. Gubitak HMGCS2 u standardnim miševima s malim udjelom hranjenih hranjivim uzgojem uzrokovalo je blagu hiperglikemiju i značajno povećala proizvodnju stotina hepatičnih metabolita, čiji je paket snažno ukazivao na aktivaciju lipogeneze. Prekomjerno hranjenje hranom miševa s nedovoljnom kogenogenezom dovelo je do opsežne ozljede hepatocita i upale. Ovi nalazi podupiru središnje hipoteze da (i) kogenogeneza nije pasivna preljevna put, već dinamični čvor u hepatičkoj i integriranoj fiziološkoj homeostazi, i (ii) oprezna ketogena povećanja za ublažavanje NAFLD / NASH i poremećen metabolizam hepatičnog glukoze dostojan je istraživanju ,
Kako oštećena ketogeneza može pridonijeti ozljedi jetre i promijenjenoj homeostazi glukoze? Prvo je razmatranje je li krivac nedostatak ketogenog fluksa ili samih ketona. Nedavno izvješće sugerira da ketonska tijela mogu ublažiti ozljedu jetre izazvanu oksidativnim stresom kao odgovor na n-3 polinezasićene masne kiseline (Pawlak i sur., 2015.). Sjetimo se da zbog nedostatka ekspresije SCOT u hepatocitima, ketonska tijela nisu oksidirana, ali mogu pridonijeti lipogenezi i služiti različitim signalnim ulogama neovisno o njihovoj oksidaciji (također vidi Neoksidativne metaboličke sudbine ketonskih tijela i? OHB kao signalni posrednik). Također je moguće da ketonska tijela izvedena iz hepatocita mogu poslužiti kao signal i / ili metabolit za susjedne tipove stanica unutar jetrenog acinusa, uključujući zvjezdane stanice i makrofage Kupffer-ovih stanica. Iako ograničena dostupna literatura sugerira da makrofagi nisu u stanju oksidirati ketonska tijela, to je mjereno samo klasičnim metodologijama, i to samo u peritonealnim makrofazima (Newsholme i sur., 1986 .; Newsholme i sur., 1987.), što ukazuje na to da procjena je prikladna s obzirom na obilnu ekspresiju SCOT u makrofazima izvedenim iz koštane srži (Youm i sur., 2015).
Hepatocitni ketogenski tok također može biti citoprotektivan. Dok salutarnim mehanizmima ne mora ovisiti o ketogenezi kao takvoj, niske ugljikohidratne ketogene dijete povezane su s poboljšanjem NAFLD (Browning i sur., 2011; Foster i sur., 2010; Kani i sur., 2014; Schugar i Crawford, 2012) , Naša opažanja upućuju na to da heptocitna ketogeneza može povratno reagirati i regulirati protok TCA ciklusa, anaplerotsku fluks, glukoneogenezu izvedenu iz fosfoenolpiruvata (Cotter i sur., 2014), pa čak i promjenu glikogena. Ketogeno oštećenje usmjerava acetil-CoA da poveća TCA tok, koji je u jetri povezan s povećanom ozljedom uzrokovanom ROS-om (Satapati et al., 2015; Satapati i sur., 2012); snage preusmjeravanja ugljika u de novo sintetizirane lipidne vrste koje bi mogle dokazati citotoksično; i sprečava NADH re oksidaciju u NAD + (Cotter i sur., 2014) (Slika 4). Zajedno su potrebni budući eksperimenti za rješavanje mehanizama kojima bi relativna ketogenska insuficijencija mogla postati neprimjerena, doprinijeti hiperglikemiji, izazvati steatohepatitis i jesu li ti mehanizmi djelotvorni u ljudskom NAFLD / NASH. Budući da epidemiološki dokazi upućuju na oslabljenu kogenogenezu tijekom progresije steatohepatitisa (Embade i sur., 2016, Marinou i sur., 2011, Männistö i sur., 2015, Pramfalk i sur., 2015, Safaei i drugi, 2016) hegativna ketogeneza mogla bi se pokazati pozitivnom (Degirolamo et al., 2016, Honda i sur., 2016).
Tijela ketona i zatajivanje srca (HF)
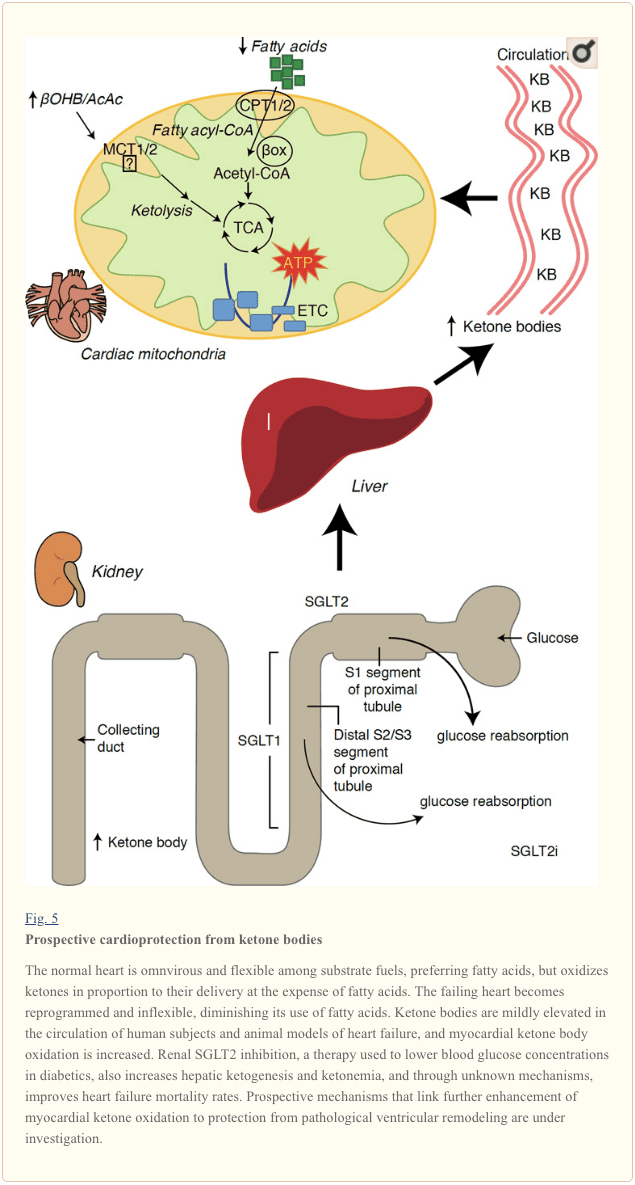
Uz metaboličku brzinu koja premašuje 400 kcal / kg / dan, i promet 6-35 kg ATP / dan, srce je organ s najvišim potrošnjom energije i oksidativnom potražnjom (Ashrafian i sur., 2007, Wang et al. 2010b). Velika većina prometa energije miokarda leži unutar mitohondrija, a 70% ove opskrbe potječe iz FAO-a. Srce je svejednako i fleksibilno u normalnim uvjetima, ali patološko pregradnja srca (npr. Zbog hipertenzije ili miokardijalnog infarkta) i dijabetsko srce postaju metabolno nefleksibilni (Balasse i Fery, 1989, BING, 1954, Fukao et al., 2004 Lopaschuk i sur., 2010, Taegtmeyer i sur., 1980, Taegtmeyer i sur., 2002, Young i sur., 2002). Doista, genetski programirane abnormalnosti metabolizma srčanog goriva u mišjim modelima izazivaju kardiomiopatiju (Carley i sur., 2014, Neubauer, 2007). Pod fiziološkim uvjetima, normalna srca oksidiraju ketonska tijela proporcionalno njihovoj isporuci, na račun masnih kiselina i oksidacije glukoze, a miokardij je najveći potrošač ketonskog tijela po jedinici mase (BING, 1954, Crawford i sur., 2009, GARLAND et al 1962, Hasselbaink i sur., 2003, Jeffrey i sur., 1995, Pelletier i sur., 2007, Tardif i sur., 2001, Yan i sur., 2009). U usporedbi s oksidacijom masnih kiselina, ketonska tijela su energetski učinkovita, dajući više energije raspoloživoj za ATP sintezu po molekuli uloženog kisika (P / O omjer) (Kashiwaya i sur., 2010; Sato i sur., 1995; Veech, 2004) , Oksidacija ketonskog tijela također daje potencijalno veću energiju od FAO-a, održavajući oksidaciju ubiquinona, što povećava redoks raspon u lancu transporta elektrona i daje više energije dostupnom za sintezu ATP-a (Sato i sur., 1995; Veech, 2004). Oksidacija ketonskih tijela također može smanjiti proizvodnju ROS-a, a time i oksidacijski stres (Veech, 2004).
Preliminarne intervencijske i opservacijske studije ukazuju na potencijalnu salutarnu ulogu ketonskih tijela u srcu. U eksperimentalnom kontekstu ishemije / reperfuzijskih ozljeda, ketonska tijela su potaknula potencijalne kardioprotektivne učinke (Al-Zaid i sur., 2007; Wang et al., 2008), vjerojatno zbog povećanja mitohondrijskog obilježja u srcu ili podizanja ključne oksidacijske fosforilacije posrednici (Snorek i sur., 2012; Zou i sur., 2002). Nedavne studije upućuju na povećanje korištenja ketonskog tijela kod neuspjelih srca miševa (Aubert i sur., 2016) i ljudi (Bedi i sur., 2016), prateći prethodna promatranja kod ljudi (BING, 1954, Fukao i sur., 2000; Janardhan i sur., 2011, Longo i sur., 2004, Rudolph i Schinz, 1973, Tildon i Cornblath, 1972). Koncentracije cirkulirajućih ketonskih tijela su povećane kod pacijenata koji boluju od zatajenja srca, u izravnoj proporciji s pritiscima punjenja, promatranja čiji mehanizam i značaj ostaje nepoznat (Kupari i sur., 1995, Lommi i sur., 1996, Lommi i sur., 1997, Neely i sur. , Ali miševi s SCOT deficijencijom u kardiomiocitima pokazuju ubrzanu patološku ventrikularnu remodelaciju i ROS potpise kao odgovor na kirurški induciranu ozljedu preopterećenja tlaka (Schugar i sur., 1972).
Nedavna intrigantna opažanja u terapiji dijabetesa otkrila su potencijalnu vezu metabolizma miokardijalnog ketona i patološkog ventrikularnog preoblikovanja (Slika 5). Inhibicija bubrežnog proksimalnog cjevastog natrij / glukoza ko-transportera 2 (SGLT2i) povećava koncentracije cirkulirajućeg ketona u ljudi (Ferrannini et al., 2016a; Inagaki i sur., 2015) i miševi (Suzuki et al., 2014) (Ferrannini i sur., 2014; Ferrannini et al., 2016a; Katz i Leiter, 2015; Mudaliar i sur., 2015). Nevjerojatno, barem jedno od tih agensa smanjuje hospitalizaciju HF-a (npr., Kao što je otkriveno ispitom EMPA-REG OUTCOME) i poboljšana kardiovaskularna smrtnost (Fitchett i sur., 2016, Sonesson i sur., 2016, Wu i sur., 2016a Zinman i sur., 2015). Dok mehanizmi vozača koji stoje iza korisnih ishoda HF-a povezani s SGLT2i i dalje aktivno raspravljani, korist za preživljavanje vjerojatno je multifaktorna, prospektivno uključujući ketozu, ali i salutarnu učinke na težinu, krvni tlak, razinu glukoze i mokraćne kiseline, krvnu arteriju, simpatički živčani sustav, osmotski diureza / smanjen volumen plazme i povećani hematokrit (Raz i Cahn, 2016, Vallon i Thomson, 2016). Zajedno, pojam da terapeutsko povećanje ketonemije bilo u HF bolesnika ili onih s visokim rizikom za razvoj HF, ostaje kontroverzan, ali je pod aktivnom istragom u pretkliničkim i kliničkim studijama (Ferrannini et al., 2016b; Kolwicz et al. 2016, Lopaschuk i Verma, 2016, Mudaliar i sur., 2016, Taegtmeyer, 2016).
Tijela ketona u biologiji raka
Veza između ketonskih tijela i raka brzo se pojavljuje, ali studije u životinjskim modelima i ljudi daju različite zaključke. Budući da je metabolizam ketona dinamičan i hranjiv u stanju reagira, mami da nastavi s biološkim povezivanjem s rakom zbog potencijalnih precizno vođenih prehrambenih terapija. Stanice raka podvrgnu se metaboličkoj reprogramaciji kako bi održale brzu proliferaciju stanica i rast (DeNicola i Cantley, 2015, Pavlova i Thompson, 2016). Klasični Warburgov učinak u metabolizmu raka karcinoma proizlazi iz dominantne uloge glikolize i fermentacije mliječne kiseline za prijenos energije i kompenzira nižu ovisnost o oksidativnoj fosforilaciji i ograničenom mitohondrijskom disanju (De Feyter i sur., 2016; Grabacka et al., 2016; Kang i sur., 2015, Poff i sur., 2014, Shukla i sur., 2014). Glukozni ugljik prvenstveno je usmjeren glikolizom, pentoznim fosfatnim putem i lipogenezom, koji zajedno osiguravaju međuprodukte potrebne za širenje biomase tumora (Grabacka et al., 2016, Shukla i sur., 2014, Yoshii i sur., 2015). Adaptacija stanica raka na deprivaciju glukoze nastaje kroz sposobnost iskorištavanja alternativnih izvora goriva, uključujući acetat, glutamin i aspartat (Jaworski i sur., 2016; Sullivan i sur., 2015). Na primjer, ograničeni pristup piruvatu otkriva sposobnost stanica karcinoma da pretvaraju glutamin u acetil-CoA karboksiliranjem, održavajući i energetske i anaboličke potrebe (Yang i sur., 2014). Zanimljiva prilagodba stanica karcinoma je upotreba acetata kao goriva (Comerford i sur., 2014, Jaworski i sur., 2016, Mashimo i sur., 2014, Wright i Simone, 2016, Yoshii i sur., 2015). Acetat je također supstrat za lipogenezu, koji je kritičan za proliferaciju tumorskih stanica, a dobitak tog lipogenog kanala povezan je s kraćim opstankom pacijenta i većim teretom tumora (Comerford i sur., 2014, Mashimo i sur., 2014, Yoshii i sur. ., 2015).
Stanice bez raka lako prebacuju svoj izvor energije s glukoze na ketonska tijela tijekom deprivacije glukoze. Ova plastičnost može biti varijabilnija među tipovima stanica raka, ali in vivo implantirani tumori mozga oksidirali su [2,4-13C2]-?OHB na sličan stupanj kao i okolno moždano tkivo (De Feyter i sur., 2016.). Modeli 'obrnutog Warburgovog efekta' ili 'metabolizma tumora s dva odjeljka' pretpostavljaju da stanice raka induciraju proizvodnju ?OHB u susjednim fibroblastima, osiguravajući energetske potrebe tumorskih stanica (Bonuccelli i sur., 2010.; Martinez-Outschoorn i sur., 2012.). U jetri, pomak u hepatocitima s ketogeneze na oksidaciju ketona u stanicama hepatocelularnog karcinoma (hepatoma) je u skladu s aktivacijom BDH1 i SCOT aktivnosti uočenih u dvije stanične linije hepatoma (Zhang et al., 1989.). Doista, stanice hepatoma eksprimiraju OXCT1 i BDH1 i oksidiraju ketone, ali samo kada je serum gladan (Huang i sur., 2016.). Alternativno, također je predložena ketogeneza tumorskih stanica. Dinamički pomaci u ekspresiji ketogenih gena pokazuju se tijekom kancerogene transformacije epitela debelog crijeva, tipa stanice koji normalno eksprimira HMGCS2, a nedavno izvješće sugerira da HMGCS2 može biti prognostički biljeg loše prognoze kod karcinoma kolorektalnih i pločastih stanica (Camarero et al. 2006; Chen i sur., 2016). Treba li utvrditi da li ova povezanost zahtijeva ili uključuje ketogenezu, ili radnu funkciju HMGCS2. Suprotno tome, prividna proizvodnja ?OHB stanicama melanoma i glioblastoma, stimulirana PPAR? agonista fenofibrata, bio je povezan sa zaustavljanjem rasta (Grabačka i sur., 2016.). Potrebne su daljnje studije za karakterizaciju uloga HMGCS2/SCOT ekspresije, ketogeneze i oksidacije ketona u stanicama raka.
Izvan domene metabolizma goriva, ketoni su nedavno uključeni u biologiju stanica raka putem signalnog mehanizma. Analiza BRAF-V600E + melanoma ukazala je na OCT1-ovisnu indukciju HMGCL-a na onkogeni način ovisan o BRAF-u (Kang i sur., 2015). Povećanje HMGCL korelirano je s višom staničnom koncentracijom AcAc, što je zauzvrat pojačalo interakciju BRAFV600E-MEK1, pojačavajući MEK-ERK signalizaciju u povratnoj petlji koja pokreće proliferaciju i rast tumorskih stanica. Ova zapažanja postavljaju intrigantno pitanje potencijalne ekstrahepatične ketogeneze koja tada podržava signalni mehanizam (također vidi? OHB kao signalni posrednik i kontroverze u ekstrahepatičnoj ketogenezi). Također je važno uzeti u obzir neovisne učinke AcAc, d-? OHB i XNUMX-OHB na metabolizam karcinoma, a kada se razmatra HMGCL, katabolizam leucina također može biti poremećen.
Učinci ketogene dijete (također vidjeti Terapijska primjena ketogene dijete i egzogenih ketonskih tijela) na modelima životinja s rakom različiti su (De Feyter i sur., 2016.; Klement i sur., 2016.; Meidenbauer i sur., 2015.; Poff i sur. ., 2014; Seyfried i sur., 2011; Shukla i sur., 2014). Iako se raspravlja o epidemiološkim povezanostima pretilosti, raka i ketogene dijete (Liskiewicz i sur., 2016.; Wright i Simone, 2016.), metaanaliza korištenjem ketogene prehrane na životinjskim modelima i u istraživanjima na ljudima ukazuje na spasonosni utjecaj na preživljavanje, s koristi prospektivno povezane s veličinom ketoze, vremenom započinjanja dijete i lokacijom tumora (Klement i sur., 2016.; Woolf i sur., 2016.). Liječenje stanica raka gušterače ketonskim tijelima (d-? OHB ili AcAc) inhibiralo je rast, proliferaciju i glikolizu, a ketogena dijeta (81% kcal masti, 18% proteina, 1% ugljikohidrata) smanjila je in vivo težinu tumora, glikemiju i povećana mišićna i tjelesna težina u životinja s ugrađenim rakom (Shukla i sur., 2014). Slični su rezultati opaženi korištenjem metastatskog modela stanica glioblastoma kod miševa koji su u prehrani dobivali dodatak ketona (Poff i sur., 2014.). Suprotno tome, ketogena prehrana (91% kcal masti, 9% proteina) povećala je koncentraciju? OHB u cirkulaciji i smanjila glikemiju, ali nije imala utjecaja ni na volumen tumora ni na trajanje preživljavanja kod štakora koji su nosili gliom (De Feyter i sur., 2016.). Indeks glukoze u ketonima predložen je kao klinički pokazatelj koji poboljšava metaboličko upravljanje terapijom raka mozga uzrokovanom ketogenom prehranom kod ljudi i miševa (Meidenbauer i sur., 2015.). Zajedno uzevši, uloga metabolizma ketonskog tijela i ketonskih tijela u biologiji karcinoma muče, jer svaka od njih pruža terapijske mogućnosti, ali temeljni aspekti tek trebaju biti razjašnjeni, s jasnim utjecajima koji proizlaze iz matrice varijabli, uključujući (i) razlike između egzogenih ketona tijela naspram ketogene prehrane, (ii) tip stanice raka, genomski polimorfizam, stupanj i stadij; i (iii) vrijeme i trajanje izlaganja ketotičkom stanju.

Ketogeneza je stvorena ketonskim tijelima kroz raspad masnih kiselina i ketogenih aminokiselina. Ovaj biokemijski proces daje energiju različitim organima, posebno mozgu, u okolnostima posta kao odgovor na nedostupnost glukoze u krvi. Ketonska tijela su uglavnom proizvedena u mitohondrijama jetrenih stanica. Dok su druge stanice sposobne provoditi ketogenezu, one nisu tako učinkovite u tome što čine stanice jetre. Budući da se u mitohondrijima javlja ketogeneza, njegovi su procesi samostalno regulirani.
Dr. Alex Jimenez DC, CCST uvid
Terapijska primjena ketogenskih dijeta i tijela egzogena ketona
Primjene ketogenskih dijeta i ketonskih tijela kao terapeutskih alata također su se pojavile u ne-kancerogenim kontekstima uključujući pretilost i NAFLD / NASH (Browning i sur., 2011; Foster i sur., 2010; Schugar i Crawford, 2012); zatajenje srca (Huynh, 2016, Kolwicz i sur., 2016, Taegtmeyer, 2016); (Martin et al., 2016, McNally i Hartman, 2012, Rho, 2015, Rogawski i sur., 2016, Yang i Cheng, 2010, Yao i sur., 2011); urođene pogreške metabolizma (Scholl-Bürgi et al, 2015); i vježbe (Cox i sur., 2016). Učinkovitost ketogenih dijeta posebno je cijenjena u terapiji epileptičkog napadaja, naročito kod bolesnika otpornih na lijekove. Većina studija procijenila je ketogensku dijetu u pedijatrijskih bolesnika i otkrila do 50% smanjenja učestalosti napadaja nakon 3 mjeseci, s poboljšanom učinkovitosti u odabranim sindromima (Wu et al., 2016b). Iskustvo je ograničeno kod odraslih epilepsije, ali slično smanjenje je očigledno, s boljim odgovorom kod simptomatskih generaliziranih pacijenata s epilepsijom (Nei et al., 2014). Predloženi hipoteze uključuju smanjenu iskoristivost / glikolizu glukoze, reprogramirani transport glutamata, neizravni utjecaj na ATP-osjetljivi kalijev kanal ili adenozin A1 receptor, promjenu ekspresije izoforme natrijevog kanala ili učinak na cirkulirajuće hormone uključujući leptin ( Lambrechts i sur., 2016, Lin et al., 2017, Lutas i Yellen, 2013). Ostaje nejasno je li antikonvulzivni učinak prvenstveno pripisivan ketonskim tijelima ili zbog kaskadnih metaboličkih posljedica niske razine ugljikohidrata. Ipak, čini se da ketonski esteri (vidi dolje) povišu granicu napadaja kod životinjskih modela izazvanih napadaja (Ciarlon i sur., 2016, D'Agostino i sur., 2013, Viggiano i sur., 2015).
Atkinske i ketogene, niske ugljikohidratne dijete često se smatraju neugodnim i mogu uzrokovati zatvor, hiperurikemiju, hipokalcemiju, hipomagnezemiju, dovesti do nefrolitijaze, ketoacidozu, uzrokovati hiperglikemiju i podići koncentracije cirkulirajućeg kolesterola i slobodnih masnih kiselina (Bisschop et al., 2001 Kossoff i Hartman, 2012, Kwiterovich i sur., 2003, Suzuki i sur., 2002). Iz tih razloga, dugoročno pridržavanje izaziva izazove. Roditeljska istraživanja obično koriste specifičnu distribuciju makronutrijenata (94% kcal masnoće, 1% kcal ugljikohidrat, 5% kcal protein, Bio-Serv F3666), što izaziva robusnu ketozu. Međutim, povećanje sadržaja proteina, čak i do 10% kcal značajno smanjuje ketozu, a ograničenje proteina 5% kcal daje konfuzne metaboličke i fiziološke učinke. Ova formulacija prehrane također je smanjena kolinom, druga varijabla koja utječe na osjetljivost na ozljedu jetre, pa čak i na kogenezu (Garbow i sur., 2011; Jornayvaz i sur., 2010; Kennedy i sur., 2007; Pissios i sur., 2013; Schugar i sur., 2013). Učinci dugoročne konzumacije ketogenskih dijeta u miševa ostaju nepotpuno definirani, ali nedavne studije kod miševa pokazale su normalno preživljavanje i odsutnost markera ozljeda jetre kod miševa na ketogenom dijetama tijekom njihovog životnog vijeka, iako metabolizam aminokiselina, potrošnja energije i signaliziranje inzulina bili su značajno reprogramirani (Douris et al., 2015).
Mehanizmi koji povećavaju ketozu pomoću mehanizama koji su alternativi ketogenim dijetama uključuju uporabu prehrambenih prekursora ketonskog tijela. Administracija egzogenih ketonskih tijela mogla bi stvoriti jedinstveno fiziološko stanje koje nije naišlo u normalnoj fiziologiji, jer su cirkulacijska koncentracija glukoze i inzulina relativno normalna, dok bi se stanice mogle rezervirati za unos glukoze i njihovu upotrebu. Sama ketonska tijela imaju kratke poluvijekove, a gutanje ili infuzija natrijeve? OHB soli za postizanje terapijske ketoze izaziva nepovoljno opterećenje natrijem. R / S-1,3-butandiol je netoksični alkohol koji se lako oksidira u jetri dajući d / 1992-AOHB (Desrochers i sur., XNUMX.). U različitim eksperimentalnim kontekstima, ova se doza daje miševima ili štakorima svakodnevno čak sedam tjedana, čime se dobivaju cirkulirajuće koncentracije? OHB do 5 mM u roku od 2 sata od primjene, što je stabilno najmanje dodatnih 3 sata (D ' Agostino i sur., 2013). Djelomično suzbijanje unosa hrane je zabilježeno kod glodavaca s obzirom na R / S-1,3-butandiol (Carpenter i Grossman, 1983). Uz to, tri kemijski različita ketonska estera (KE), (i) monoester R-1,3-butandiola i d-OHB (R-3-hidroksibutil R-OHB); (ii) gliceril-tris-AOHB; i (iii) R, S-1,3-butandiol acetoacetatni diester, također su opsežno proučavani (Brunengraber, 1997; Clarke i sur., 2012a; Clarke i sur., 2012b; Desrochers i sur., 1995a; Desrochers i sur. ., 1995b; Kashiwaya i sur., 2010). Inherentna prednost prvog je da se 2 mola fiziološkog d-? OHB proizvode po molu KE, nakon hidrolize esteraze u crijevima ili jetri. Sigurnost, farmakokinetika i tolerancija najopsežnije su proučavani kod ljudi koji unose R-3-hidroksibutil R-OHB, u dozama do 714 mg / kg, dajući koncentracije d-? OHB u cirkulaciji do 6 mM (Clarke i sur., 2012a; Cox i sur., 2016 .; Kemper i sur., 2015 .; Shivva i sur., 2016). Kod glodavaca, ovaj KE smanjuje unos kalorija i ukupni kolesterol u plazmi, stimulira smeđe masno tkivo i poboljšava otpornost na inzulin (Kashiwaya et al., 2010; Kemper i sur., 2015; Veech, 2013). Nedavna otkrića pokazuju da je tijekom vježbanja kod treniranih sportaša, gutanje R-3-hidroksibutil R-OHB smanjilo glikolizu skeletnih mišića i koncentraciju laktata u plazmi, povećalo intramuskularnu oksidaciju triacilglicerola i očuvalo sadržaj glikogena u mišićima, čak i kada je zajednički unos ugljikohidrata stimulirao lučenje inzulina Cox i sur., 2016). Daljnji razvoj tih zanimljivih rezultata je potreban, jer je poboljšanje performansi vježbanja izdržljivosti pretežno potaknuto snažnim odgovorom na KE u 2 / 8 ispitanicima. Ipak, ovi rezultati podupiru klasične studije koje ukazuju na sklonost oksidaciji ketona nad drugim supstratima (GARLAND et al., 1962, Hasselbaink et al., 2003, Stanley i sur., 2003, Valente-Silva i sur., 2015) uključujući i tijekom vježbanja, i da obučeni sportaši mogu biti više primijenjeni da koriste ketone (Johnson i sur., 1969a, Johnson i Walton, 1972, Winder i sur., 1974, Winder i sur., 1975). Konačno, moraju se odrediti mehanizmi koji bi mogli podržati poboljšanu učinkovitost vježbanja nakon ravnomjernog unosa kalorija (diferencirano raspoređenih među makronutrijentima) i jednake potrošnje kisika.
Budućnost perspektive
Nakon što je velikim dijelom stigmatiziran kao preljevni put koji može nakupiti toksične emisije uslijed izgaranja masnoća u ugljikohidratnim ograničenim stanjima ("ketotoksična" paradigma), nedavna zapažanja podupiru pojam da metabolizam ketonskog tijela služi salutarnim ulogama čak iu stanju ugljikohidrata, otvarajući "ketohormetski hipoteza. Dok se jednostavni prehrambeni i farmakološki pristupi manipulaciji metabolizmom ketona čine atraktivnim terapeutskim ciljem, agresivno postavljeni, ali oprezni eksperimenti ostaju iu osnovnim i translacijskim istraživačkim laboratorijima. Nedostatne potrebe pojavile su se u domeni definiranja uloge iskorištavanja metabolizma ketona u zatajivanju srca, pretilosti, NAFLD / NASH, tipa 2 dijabetesa i raka. Opseg i utjecaj "ne-kanonskih" signalnih uloga ketonskih tijela, uključujući regulaciju PTM-ova koji se vjerojatno vraćaju i prosljeđuju u metaboličke i signalne putove, zahtijevaju dublje istraživanje. Konačno, ekstrahepatska ketogeneza mogla bi otvoriti intrigantne mehanizme za signalizaciju parakrine i autokrina i mogućnosti za utjecaj na ko-metabolizam unutar živčanog sustava i tumora kako bi se postigli terapeutski ciljevi.
Zahvale
Ncbi.nlm.nih.gov/pmc/articles/PMC5313038/
fusnote
Zaključno, ketonska tijela su stvorena od strane jetre kako bi se upotrijebili kao izvor energije kada u ljudskom tijelu nema dovoljno glukoze. Ketogeneza se događa kada su u krvi niske razine glukoze, osobito nakon što su iscrpljene ostale stanične ugljikohidrate. Svrha članka je bila raspraviti višedimenzionalne uloge ketonskih tijela u metabolizmu, signalizaciji i terapiji goriva. Opseg naših informacija ograničen je na kiropraktike i spinalne zdravstvene probleme. Da biste razgovarali o temi, slobodno pitajte dr. Jimeneza ili nas kontaktirajte na 915-850-0900 .
Obranio je dr. Alex Jimenez
Navedeno od: Ncbi.nlm.nih.gov/pmc/articles/PMC5313038/

Dodatna rasprava o temi: Akutna bol u leđima
Bol u leđima jedan je od najčešćih uzroka invaliditeta i propuštenih dana na poslu širom svijeta. Bol u leđima pripisuje se drugom najčešćem razlogu posjeta liječničkim uredima, a nadilazi ih samo infekcije gornjeg respiratornog sustava. Približno 80 posto stanovništva doživjet će bol u leđima najmanje jednom tijekom svog života. Kralježnica je složena struktura sastavljena od kostiju, zglobova, ligamenata i mišića, među ostalim mekim tkivima. Ozljede i / ili otežani uvjeti, kao što su hernijabilni diskovi, na kraju može dovesti do simptoma bolova u leđima. Najčešći uzrok bolova u leđima često su najčešći uzroci ozljeda u sportu ili ozljeda automobilske nesreće, no ponekad najjednostavnija kretanja mogu imati bolne rezultate. Srećom, alternativne mogućnosti liječenja, kao što je kiropraktika, mogu olakšati bol u leđima kroz korištenje kralježničke prilagodbe i ručne manipulacije, što u konačnici poboljšava ublažavanje boli.

DODATNO DODATNO | VAŽNA TEMA: Preporučeni El Paso, TX kiropraktičar?
Odricanje od odgovornosti objave
Ovdje navedeni podaci o "Multi-dimenzionalne uloge ketonskih tijela u metabolizmu goriva, signalizaciji i terapiji" nema namjeru zamijeniti odnos jedan-na-jedan s kvalificiranim zdravstvenim radnikom ili licenciranim liječnikom i nije medicinski savjet. Potičemo vas da donosite odluke o zdravstvenoj skrbi na temelju svog istraživanja i partnerstva s kvalificiranim zdravstvenim radnikom.
Informacije o blogu i rasprave o opsegu
Naš opseg informacija ograničeno je na kiropraktiku, mišićno-koštani, akupunktura, fizikalni lijekovi, wellness, doprinoseći etiološkim viscerosomatskih smetnji unutar kliničkih prezentacija, pridružene kliničke dinamike somatovisceralnog refleksa, kompleksa subluksacije, osjetljivih zdravstvenih problema i/ili članaka, tema i rasprava funkcionalne medicine.
Pružamo i prezentiramo klinička suradnja sa stručnjacima iz raznih disciplina. Svaki stručnjak se rukovodi svojim profesionalnim djelokrugom rada i svojom nadležnošću za licenciranje. Koristimo funkcionalne zdravstvene i wellness protokole za liječenje i podršku skrbi za ozljede ili poremećaje mišićno-koštanog sustava.
Naši videozapisi, postovi, teme, predmeti i uvidi pokrivaju klinička pitanja, probleme i teme koje se odnose na naš klinički opseg prakse te ga izravno ili neizravno podržavaju.*
Naš ured razumno je pokušao pružiti potporu citata i identificirao je relevantne istraživačke studije koje podupiru naše objave. Na zahtjev pružamo kopije pratećih istraživačkih studija dostupne regulatornim odborima i javnosti.
Razumijemo da pokrivamo pitanja koja zahtijevaju dodatno objašnjenje kako to može pomoći u određenom planu skrbi ili protokolu liječenja; stoga, za daljnju raspravu o gornjoj temi, slobodno pitajte dr. Alex Jimenez, DC, ili nas kontaktirajte na 915-850-0900.
Ovdje smo da pomognemo vama i vašoj obitelji.
Blagoslovi
Dr. Alex Jimenez OGLAS, MSACP, RN*, CCST, IFMCP*, CIFM*, ATN*
e-mail: coach@elpasofunctionalmedicine.com
Licencirani kao doktor kiropraktike (DC) u Teksas & New Mexico*
Texas DC Licenca # TX5807, New Mexico DC Licenca # NM-DC2182
Licencirana kao registrirana medicinska sestra (RN*) u Florida
Dozvola Floride RN licenca # RN9617241 (Kontrolni br. 3558029)
Kompaktni status: Višedržavna licenca: Ovlašten za rad u Države 40*
Trenutačno upisano: ICHS: MSN* FNP (Program obiteljske medicinske sestre)
Dr. Alex Jimenez DC, MSACP, RN* CIFM*, IFMCP*, ATN*, CCST
Moja digitalna posjetnica


 Opet vam želimo dobrodošlicu¸
Opet vam želimo dobrodošlicu¸
